题目内容
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 16g甲基正离子(13CH3+)所含中子数为9NA | |
| C. | 3.0 g淀粉和葡萄糖混合物中共含碳原子数0.1NA | |
| D. | 标准状况下,1mol SO3含有的分子数为NA |
分析 A、该反应中双氧水的化合价为-1价,生成1mol氧气转移了2mol电子;
B、质量换算物质的量,结合质量数=质子数+中子数 计算离子中中子数;
C、淀粉和葡萄糖的最简式不同,不能计算原子数;
D、根据分子数N=nNA来计算.
解答 解:A、32g氧气的物质的量为1mol,在H2O2+Cl2═2HCl+O2反应中,双氧水中-1价氧元素被氧化成0价氧气,生成1mol氧气转移了2mol电子,转移2NA个电子,故A错误;
B、16g甲基正离子(13CH3+)物质的量为1mol,含中子数为1mol×(13-6)=7mol,故B错误;
C、淀粉和葡萄糖的最简式不同,故混合物中的碳原子数不能计算,故C错误;
D、1mol三氧化硫中的分子数N=nNA=NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
6.下列物质中与CH3-CH2-CH2-CH3互为同分异构体的是( )
| A. | CH3-CH3 | B. | CH3-CH2-CH3 | C. | 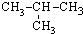 | D. | 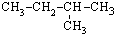 |
4.下列各种冶炼方法中,可制得相应金属的为( )
| A. | 加热氧化铝 | B. | 电解熔融氯化镁 | C. | 加热碳酸钠 | D. | 电解饱和食盐水 |
11.下列离子方程式正确的是( )
| A. | 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO-3═Fe3++NO↑+2H2O | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: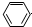 -O-+CO2+H2O→ -O-+CO2+H2O→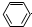 -OH+HCO3- -OH+HCO3- |
1.下列说法正确的是( )
| A. | 合成纤维和人造纤维统称为化学纤维 | |
| B. | 酚醛塑料和聚氯乙烯都是热固性塑料 | |
| C. | 锦纶丝接近火焰时先卷缩,燃烧时有烧焦羽毛的气味,灰烬为有光泽的硬块,能压成粉末 | |
| D. | 对于某些合成材料和塑料制品废弃物的处理可以倾倒到海洋中 |
8.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 实验室以H2O2和MnO2为原料制取O2,每生成1mol O2转移2NA个电子 |
10.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2为( )
| A. | 7.5 mL | B. | 15.0 mL | C. | 17.5 mL | D. | 35.0 mL |
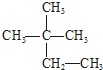 ③C60 ④氯气 ⑤
③C60 ④氯气 ⑤ ⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.
⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.