题目内容
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
Si(粗)+3HCl(g) 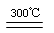 SiHCl3(g) + H2、 ②SiHCl3 (g) + H2
SiHCl3(g) + H2、 ②SiHCl3 (g) + H2  Si(纯) + 3HCl(g)
Si(纯) + 3HCl(g)
对上述两个反应的叙述错误的是
| A.两个反应互为可逆反应 | B.都是置换反应 |
| C.都是氧化还原反应 | D.都不是离子反应 |
A
解析试题分析:A、两个反应条件不同,不能互为可逆反应,A不正确;B、这两个反应都是单质和化合物反应生成另外的单质和化合物,所以都是置换反应,故B正确;C、这两个反应都有电子的转移,所以都是氧化还原反应,故C正确;D、这两个反应都没有离子参加,所以都不是离子反应,故D正确;故选:A。
考点:考查氧化还原反应、置换反应、离子反应等有关判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g) 2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
| A.小于0.15 mol | B.等于0.3 mol |
| C.等于0.15 mol | D.大于0.15 mol,小于0.3 mol |
下列关于化学反应限度的叙述中正确的是( )
| A.化学反应的限度都相同 |
| B.可以通过改变反应条件控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应限度 |
| D.当一个化学反应在一定条件下达到限度时反应即停止 |
使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均速率v(X)为
| A.v(NH3)=0.04mol·L-1·s-1 | B.v(O2)=0.015mol·L-1·s-1 |
| C.v(N2)=0.02mol·L-1·s-1 | D.v(H2O)=0.02mol·L-1·s-1 |
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:
①降温;②把镁条粉碎;③加入蒸馏水使盐酸变稀;④升温
| A.①② | B.②③ | C.①③ | D.②④ |
100 mL浓度为2 mol/L的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量NaCl溶液 | B.加入适量NaOH溶液 |
| C.加入数滴CuCl2溶液 | D.加入适量NaNO3溶液 |
 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1

 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响