题目内容
可逆反应A(g)+3B(g) 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)
B
解析试题分析:反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快、A、v(A)/1=0.15mol/(L?min),B、v(B)/3=0.2mol/(L?min),C、v(C)/2=0.15mol/(L?min),D、v(D)/2=0.05mol/(L?min),所以反应速率v(B)>v(A)=v(C)>v(D),故选B。
考点:考查化学反应速率的表示以及大小比较

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
| A.等于5 s | B.大于10 s | C.等于10 s | D.小于10 s |
右图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,
2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,
下列叙述正确的是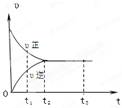
| A.t1时,只有正方向反应 | B.t2时,反应到达限度 |
| C.t2~ t3,反应不再发生 | D.t2~t3,各物质的浓度一定相等 |
从下列实验事实所引起的相应结论不正确的是:
| 选项 | 实 验 事 实 | 结 论 |
| A | 其它条件不变, 0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 | 当其它条件不变时,增大反应物浓度可以使化学反应速率加快 |
| B | 其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊。 | 当其它条件不变时,反应体系的温度越高、化学反应速率越快 |
| C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
| D | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) 2HI(g),获得等量HI时需要的时间前者少。 2HI(g),获得等量HI时需要的时间前者少。 | 当其它条件不变时,气态反应体系的压强越大、化学反应速率越快 |
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g) 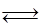 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表: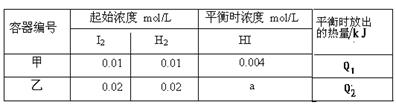
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
Si(粗)+3HCl(g) 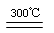 SiHCl3(g) + H2、 ②SiHCl3 (g) + H2
SiHCl3(g) + H2、 ②SiHCl3 (g) + H2  Si(纯) + 3HCl(g)
Si(纯) + 3HCl(g)
对上述两个反应的叙述错误的是
| A.两个反应互为可逆反应 | B.都是置换反应 |
| C.都是氧化还原反应 | D.都不是离子反应 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是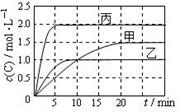
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
A.10min内甲容器中反应的平均速率: v(A) = 0.05mol·(L·min)-1
B.由图可知T1>T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂
向某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是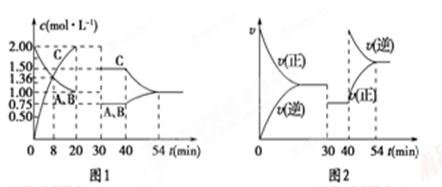
| A.30 min时改变的条件是降低温度,40 min时改变的条件是升高温度 |
| B.8 min前A的平均反应速率为0.08 mol/(L·min) |
| C.反应的化学方程式中的x=1,且正反应为吸热反应 |
| D.20 min后该反应的平衡常数均为4 |