题目内容
使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均速率v(X)为
| A.v(NH3)=0.04mol·L-1·s-1 | B.v(O2)=0.015mol·L-1·s-1 |
| C.v(N2)=0.02mol·L-1·s-1 | D.v(H2O)=0.02mol·L-1·s-1 |
B
解析试题分析:根据v=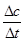 计算v(N2),再利用速率之比等于化学计量数之比计算各物质表示的反应速率,进行判断。在体积2L的密闭容器中进行,半分钟后,氮气的物质的量增加了0.60mol,其浓度为0.60mol÷2L=0.30mol/L,则v(N2)=0.30mol/L÷30s=0.01mol?L-1?s-1,A、速率之比等于化学计量数之比,所以v(NH3)=
计算v(N2),再利用速率之比等于化学计量数之比计算各物质表示的反应速率,进行判断。在体积2L的密闭容器中进行,半分钟后,氮气的物质的量增加了0.60mol,其浓度为0.60mol÷2L=0.30mol/L,则v(N2)=0.30mol/L÷30s=0.01mol?L-1?s-1,A、速率之比等于化学计量数之比,所以v(NH3)=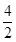 ×0.01mol?L-1?s-1=0.020mol?L-1?s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=
×0.01mol?L-1?s-1=0.020mol?L-1?s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=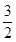 ×0.01mol?L-1?s-1=0.0150mol?L-1?s-1,故B正确;C、v(N2)=0.30mol/L÷30s=0.01mol?L-1?s-1,故C不正确;D、速率之比等于化学计量数之比,所以v(H2O)=
×0.01mol?L-1?s-1=0.0150mol?L-1?s-1,故B正确;C、v(N2)=0.30mol/L÷30s=0.01mol?L-1?s-1,故C不正确;D、速率之比等于化学计量数之比,所以v(H2O)=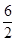 ×0.01mol?L-1?s-1=0.03mol?L-1?s-1,故D错误,故选B。
×0.01mol?L-1?s-1=0.03mol?L-1?s-1,故D错误,故选B。
考点:考查化学反应速率的计算

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案从下列实验事实所引起的相应结论不正确的是:
| 选项 | 实 验 事 实 | 结 论 |
| A | 其它条件不变, 0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 | 当其它条件不变时,增大反应物浓度可以使化学反应速率加快 |
| B | 其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊。 | 当其它条件不变时,反应体系的温度越高、化学反应速率越快 |
| C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
| D | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) 2HI(g),获得等量HI时需要的时间前者少。 2HI(g),获得等量HI时需要的时间前者少。 | 当其它条件不变时,气态反应体系的压强越大、化学反应速率越快 |
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
Si(粗)+3HCl(g) 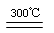 SiHCl3(g) + H2、 ②SiHCl3 (g) + H2
SiHCl3(g) + H2、 ②SiHCl3 (g) + H2  Si(纯) + 3HCl(g)
Si(纯) + 3HCl(g)
对上述两个反应的叙述错误的是
| A.两个反应互为可逆反应 | B.都是置换反应 |
| C.都是氧化还原反应 | D.都不是离子反应 |
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
| A.平衡向逆反应方向移动 | B.A的转化率降低 |
| C.m+n>p | D.C的体积分数减小 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是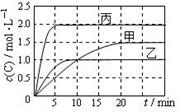
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
A.10min内甲容器中反应的平均速率: v(A) = 0.05mol·(L·min)-1
B.由图可知T1>T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂
已知4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是 ( )
| A.4/5v(NH3)=v(O2) | B.5/6v(O2)=v(H2O) | C.2/3v(NH3)=v(H2O) | D.4/5v(O2)=v(NO) |
已知反应①CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
| A.反应①的平衡常数 |
B.反应③的平衡常K=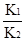 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是