题目内容
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:
①降温;②把镁条粉碎;③加入蒸馏水使盐酸变稀;④升温
| A.①② | B.②③ | C.①③ | D.②④ |
C
解析试题分析:对于镁和盐酸的反应,可增大浓度、升高温度、增大固体的表面积,或形成原电池反应,可增大反应速率,反之反应速率降低,以此解答该题。①降温,活化分子百分数减小,反应速率减小,故正确;②把镁条粉碎,固体表面积增大,反应速率增大,故错误;③加入蒸馏水使盐酸变稀,浓度减小,反应速率减小,故正确;④升温,活化分子百分数增大,反应速率增大,故错误,故选C。
考点:考查外界条件对化学反应速率的影响

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g) 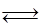 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表: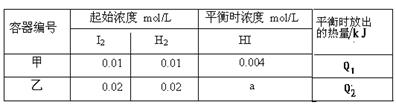
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
Si(粗)+3HCl(g) 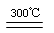 SiHCl3(g) + H2、 ②SiHCl3 (g) + H2
SiHCl3(g) + H2、 ②SiHCl3 (g) + H2  Si(纯) + 3HCl(g)
Si(纯) + 3HCl(g)
对上述两个反应的叙述错误的是
| A.两个反应互为可逆反应 | B.都是置换反应 |
| C.都是氧化还原反应 | D.都不是离子反应 |
可逆反应mA(g)+nB(g) pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是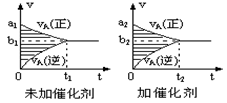
| A.②③⑤⑧ | B.①④⑥⑧ | C.②④⑤⑦ | D.①③⑥⑦ |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是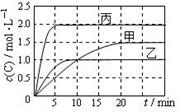
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
A.10min内甲容器中反应的平均速率: v(A) = 0.05mol·(L·min)-1
B.由图可知T1>T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
| A.②④ | B.③④ | C.③⑤ | D.①③ |
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )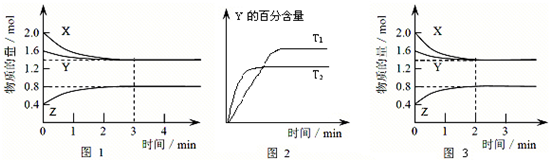
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1 |
| B.容器中发生的反应可表示为:3X(g)+Y(g) =2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) =" 0.03" mol·L-1·min-1