题目内容
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
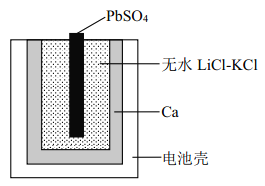
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
【答案】低温 3H2O―6e―=O3+6H+ n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的物质,所以减少(或NO2发生副反应,所以n(NO2)减少也给分) 该反应的活化能高,反应速率慢 BC 100 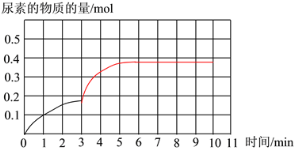
达到平衡时尿素的物质的量<0.5 mol,反应达到平衡的时间在10 min之前
【解析】
(1)SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g)反应为熵减的反应,熵减的反应在低温下有利于自发进行。
(2)用惰性电极电解稀硫酸,H+在阴极得电子发生还原反应,电极反应式为:2H++e-=H2↑;OH-在阳极失电子发生氧化反应,电极反应式为:3H2O―6e―=O3+6H+,则产生O3的电极反应式为:3H2O―6e―=O3+6H+。
(3)①n(O3):n(NO)<1时,NO被O3氧化为NO2,所以增加;n(O3):n(NO)>1,NO2被转化为更高价的氮氧化物,所以减少。
②臭氧的量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,若用过渡态理论解释可能是该反应的活化能高,反应速率慢。
(4)A.由左图可知相同时间内脱硫率大于脱硝率,则v(脱硫)>v(脱硝),故A错误;
B.由右图可知,随尿素溶液pH的增大,脱硫率的曲线没变化,但脱硝率曲线变化比较大,故尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响,故B正确;
C.如右图所示,pH越大脱除率越高,则强酸性条件下不利于尿素对氮氧化物的脱除,故C正确;
D.如右图所示,溶液的pH对脱硫率没有影响,故D错误。
(5)①NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)反应10 min后达到平衡,容器中气体密度为4.8 g·L-1,则容器中气体的质量为4.8 g·L-1×10L=48g,
2NH3(g) + CO2(g)CO(NH2)2(s)+H2O(g)
起始量(mol/L)0.2 0.1 0 0
变化量(mol/L)2x x x x
平衡量(mol/L)0.2-2x 0.1-x x x
则(0.2-2x)mol/L×10L×17g/mol+(0.1-x)mol/L×10L×44g/mol+xmol/L×10L×18g/mol=48, x=0.05,K=![]() 。
。
②通过①的分析可知,若温度不变,反应10 min后达到平衡,CO(NH2)2的物质的量为0.5mol。由于此反应为放热反应,升高温度,正逆反应速率均增大,达到平衡的时间小于10min,平衡向逆向移动,CO(NH2)2的物质的量为小于0.5mol。据此解答。
(1)SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g)反应为熵减的反应,熵减的反应在低温下有利于自发进行。本小题答案为:低温。
(2)用惰性电极电解稀硫酸,H+在阴极得电子发生还原反应,电极反应式为:2H++e-=H2↑;OH-在阳极失电子发生氧化反应,电极反应式为:3H2O―6e―=O3+6H+,则产生O3的电极反应式为:3H2O―6e―=O3+6H+/span>。本小题答案为:3H2O―6e―=O3+6H+。
(3)①n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的氮氧化物,所以减少。本小题答案为:n(O3):n(NO)<1时,NO被O3氧化为NO2所以增加;n(O3):n(NO)>1,NO2被转化为更高价的物质,所以减少。
②臭氧的量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,若用过渡态理论解释可能是该反应的活化能高,反应速率慢。本小题答案为:该反应的活化能高,反应速率慢。
(4)A.由左图可知相同时间内脱硫率大于脱硝率,则v(脱硫)>v(脱硝),故A错误;
B.由右图可知,随尿素溶液pH的增大,脱硫率的曲线没变化,但脱硝率曲线变化比较大,故尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响,故B正确;
C.如右图所示,pH越大脱除率越高,则强酸性条件下不利于尿素对氮氧化物的脱除,故C正确;
D.如右图所示,溶液的pH对脱硫率没有影响,故D错误。答案选BC。
(5)①NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)反应10 min后达到平衡,容器中气体密度为4.8 g·L-1,则容器中气体的质量为4.8 g·L-1×10L=48g,
2NH3(g) + CO2(g)CO(NH2)2(s)+H2O(g)
起始量(mol/L)0.2 0.1 0 0
变化量(mol/L)2x x x x
平衡量(mol/L)0.2-2x 0.1-x x x
则(0.2-2x)mol/L×10L×17g/mol+(0.1-x)mol/L×10L×44g/mol+xmol/L×10L×18g/mol=48, x=0.05,K=![]() 。本小题答案为:100。
。本小题答案为:100。
②通过①的分析可知,若温度不变,反应10 min后达到平衡,CO(NH2)2的物质的量为0.5mol。由于此反应为放热反应,升高温度,正逆反应速率均增大,达到平衡的时间小于10min,平衡向逆向移动,CO(NH2)2的物质的量为小于0.5mol,图像为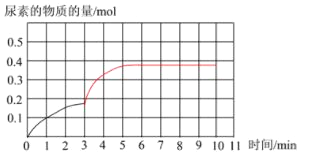 。本小题答案为:
。本小题答案为: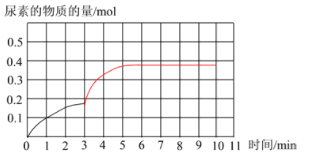 。
。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案