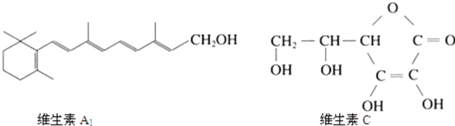
题目内容
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。下列说法正确的是
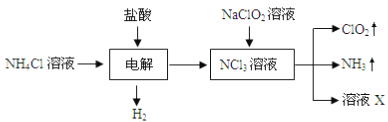
A. 电解时发生反应的离子方程式为NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B. 溶液X中大量存在的阴离子有Cl-、OH-
C. 可用饱和食盐水除去ClO2中的NH3
D. 常用作净水剂的明矾可除去饮用水中残留的NaClO2
【答案】B
【解析】
A项,由图示电解NH4Cl和盐酸的混合溶液制得H2和NCl3溶液,反应的离子方程式为NH4++3Cl-+2H+![]() 3H2↑+NCl3,错误;B项,NCl3溶液中加入NaClO2溶液生成ClO2、NH3和溶液X,NaClO2被氧化成ClO2,NCl3被还原成NH3,反应的化学方程式为6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH,溶液X中大量存在的阴离子为Cl-、OH-,正确;C项,ClO2是一种黄绿色易溶于水的气体,饱和食盐水不仅吸收NH3而且吸收ClO2,不能用饱和食盐水除去ClO2中的NH3,错误;D项,明矾作为净水剂的原因是:Al3+发生水解生成Al(OH)3胶体吸附水中的悬浮物,明矾不能除去饮用水中残留的NaClO2,错误;答案选B。
3H2↑+NCl3,错误;B项,NCl3溶液中加入NaClO2溶液生成ClO2、NH3和溶液X,NaClO2被氧化成ClO2,NCl3被还原成NH3,反应的化学方程式为6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH,溶液X中大量存在的阴离子为Cl-、OH-,正确;C项,ClO2是一种黄绿色易溶于水的气体,饱和食盐水不仅吸收NH3而且吸收ClO2,不能用饱和食盐水除去ClO2中的NH3,错误;D项,明矾作为净水剂的原因是:Al3+发生水解生成Al(OH)3胶体吸附水中的悬浮物,明矾不能除去饮用水中残留的NaClO2,错误;答案选B。

【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)![]() Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小