题目内容
【题目】常温下,下列说法正确的是![]()
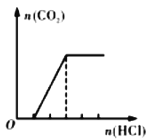
A.分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH
B.![]() 的
的![]() 溶液加水稀释
溶液加水稀释![]() 倍后,
倍后,![]()
C.pH相等的![]() 、NaOH溶液中,水的电离程度相同
、NaOH溶液中,水的电离程度相同
D.![]() 溶液中:
溶液中:![]()
【答案】D
【解析】
A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释![]() 倍后,溶液的pH变化小于n;
倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断。
![]() 分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.![]() 的
的![]() 溶液加水稀释
溶液加水稀释![]() 倍后,稀释过程中醋酸的电离程度增大,则稀释
倍后,稀释过程中醋酸的电离程度增大,则稀释![]() 倍后,溶液的pH变化小于n,即稀释后溶液的
倍后,溶液的pH变化小于n,即稀释后溶液的![]() ,故B错误;
,故B错误;
C.pH相等的![]() 、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.![]() 溶液中,根据质子守恒可得:
溶液中,根据质子守恒可得:![]() ,故D正确;
,故D正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目