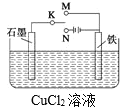
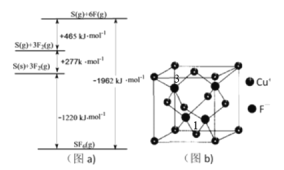
题目内容
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
【答案】A
【解析】
25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1;则H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1①,C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),则此反应的△H =2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1,故答案为A。
O2(g)=H2O(l)△H=-285.8kJmol-1①,C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),则此反应的△H =2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1,故答案为A。

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目