题目内容
【题目】某化学实验室需要0.5mol·L-1硫酸溶液450mL。根据溶液的配制情况回答下列问题:
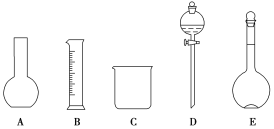
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。
(2)现用质量分数为98%、密度为1.84g·cm-3的浓硫酸来配制450mL、0.5mol·L-1的稀硫酸。计算所需浓硫酸的体积为__mL(保留1位小数),现有①10mL ②25mL ③50mL ④100mL四种规格的量筒,你选用的量筒是__(填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→⑧→__→__→__→_(填序号)。__
(4)在配制过程中,下列操作中错误的是__(填代号,下同),其他操作都准确,能引起误差偏高的有__。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
【答案】AD 玻璃棒、胶头滴管 13.6 ② ⑤⑥⑦④ ①②③④⑥⑦ ①②⑦
【解析】
根据配制一定物质的量浓度溶液需用到仪器选择;依据c= ![]() 求得质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积,依据浓硫酸体积选择合适规格量筒;依据配制一定物质的量浓度溶液的正确操作步骤判断,根据c=
求得质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积,依据浓硫酸体积选择合适规格量筒;依据配制一定物质的量浓度溶液的正确操作步骤判断,根据c= ![]() ,分析操作对溶质的物质的量或对溶液的体积的影响判断实验误差。
,分析操作对溶质的物质的量或对溶液的体积的影响判断实验误差。
(1)配制一定物质的量浓度溶液用到的仪器有:托盘天平或者量筒、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,并不需要的是AD,还缺少的是玻璃棒、胶头滴管;答案为AD,玻璃棒、胶头滴管。
(2)因无450 mL的容量瓶,配制稀硫酸溶液要用500 mL的容量瓶,c(浓)V(浓)=c(稀)V(稀),即![]() ×V(浓)=0.5×0.5,得V(浓)≈0.013 6 L=13.6 mL;根据V=13.6mL,选用25 mL量筒最好,误差小;答案为13.6,②。
×V(浓)=0.5×0.5,得V(浓)≈0.013 6 L=13.6 mL;根据V=13.6mL,选用25 mL量筒最好,误差小;答案为13.6,②。
(3)用浓硫酸配制一定浓度的稀硫酸的操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,其正确的操作顺序为:②→①→③→⑧→⑤→⑥→⑦→④;答案为⑤⑥⑦④。
(4)依据c=![]() 分析,凡是使n偏小或者使V偏大的操作都会是溶液的浓度偏低,反之偏高。
分析,凡是使n偏小或者使V偏大的操作都会是溶液的浓度偏低,反之偏高。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,溶质的物质的量n偏大,溶液浓度偏高,操作错误;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,温度高,体积增大,导致配制时所加水量减小,溶液的浓度偏高,操作错误;
③浓硫酸稀释时要将浓硫酸注入水中,而不能将水注入浓硫酸中,操作错误;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,操作错误;
⑤转移前,容量瓶中含有少量蒸馏水,对溶液浓度无影响,操作正确;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,操作错误;
⑦定容时,俯视标线,导致溶液体积偏小,溶液浓度偏高,操作错误;
所以:操作错误的为:①②③④⑥⑦,能引起误差偏高的有①②⑦;答案为①②③④⑥⑦,①②⑦。