题目内容
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气)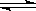 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为 ;平衡时,气体的总物质的量是 。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为 。
(1)0.4 5mol
(2)2<n(x)/n(y)<5
解析试题分析:(1)同温、同压条件下,充入物质的物质的量比与原平衡时的比值相同,则两个平衡等效。本题中,开始时X、Y的物质的量比是2:1,后来X、Y的物质的量比是4:2=2:1,所以再达平衡与原平衡等效,Z的体积分数仍是0.4;设Y转化xmol,则X转化2xmol,生成Z2xmol,则有2x/(4-2x+2-x+2x)=0.4,解得x=1,所以平衡时气体的总物质的量是4-2x+2-x+2x=5mol;
(2)设n(X)/n(Y)=a,Y转化xmol,根据(1)知平衡时气体总物质的量是n(X)+ n(Y)-x,则Z的体积分数=2x/(n(X)+ n(Y)-x)=0.4,即x/ n(Y)=(a+1)/6,也是Y的转化率。根据(1)的计算得知原平衡中Y的转化率是50%。保持容器的体积不变,与原平衡比压强减小,压强减小,平衡逆向移动,导致Z的体积分数小于0.4,要想保持Z的体积分数仍为0.4,所以需要增大压强,使平衡右移,Y的转化率将大于50%,所以(a+1)/6>50%,解得a>2;又可逆反应中Y的转化率(a+1)/6<1,解得a<5,所以2<a<5。
考点:考查等效平衡的判断及计算

甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。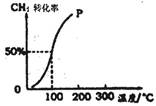
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |

CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2 下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(1)写出H2O2在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
 zC达到平衡:
zC达到平衡: 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。 CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求: