题目内容
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是
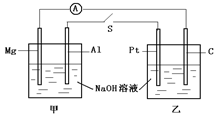

| A.电流计指针不发生偏转 |
| B.Al、Pt两电极有氢气生成 |
| C.甲池pH减小,乙池pH不变 |
| D.Mg、C两电极生成的气体在一定条件下可恰好完全反应 |
D
试题分析:Al是负极,Mg是正极
负极:Al + 4OH- -3e- =AlO2- +2H2O
正极:2H2O + 2e- =H2↑ + 2OH-
总反应式:2Al +2NaOH +H2O = 2NaAlO2+3H2 ↑
Pt是阴极,C是阳极
阳极:4OH- - 4e = 2H2O + O2↑
阴极:2H2O + 2e = H2↑ + 2OH-
总反应式:2H2O = 2H2↑ + O2↑
A、错误。左边是原电池,右边是电解池,电流表指针发生偏转。
B、错误。Al是负极,没有H2;Mg是正极,产生H2
C、错误。乙是电解水,水减少,NaOH浓度增大,pH增大
D、正确。正好产生H2和O2,且体积比是2:1,一定条件下可恰好完全反应。
故选D
点评:注意分析装置的特点,准确判断出原电池(1、有活动性不同的电极,2、有电解质溶液,3、有闭合回路,4、有自发的氧化还原反应。)与电解池(特点:有外接电源)。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是
 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。