题目内容
如右图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,正确的是( )
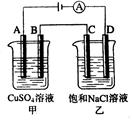
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑

A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑
C
试题分析:A为电解池的阳极,发生氧化反应:4OH--4e=2H2O ,故A错
D极为电解池的阴极发生还原反应:2H2O+4e+O2="4OH-" ,所以滴入酚酞D极附近先变红,C对
故B极发生还原反应Cu2++2e=Cu C极发生氧化反应2Cl--2e=Cl2故B、D错
点评:该题考查串联电解池,比简单的电解池较为复杂,在解题过程中注意分析电子的流动方向,确定电极反应式。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

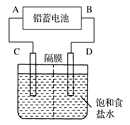
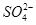 -2e-===PbSO4
-2e-===PbSO4 2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )
2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( ) CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
 2PbSO4+2H2O)( )
2PbSO4+2H2O)( )