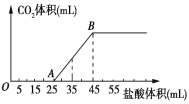
题目内容
【题目】铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________(填元素名称),各元素的第一电离能由大到小的顺序为___________________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_________晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为_________(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为__________g·cm-3(用含有r、NA的最简代数式表示)。
【答案】铁 N>C>Fe>K 3:4 分子 8 ![]()
![]()
【解析】
(1)K的原子核外电子数为19,价电子排布式为4s1,Fe的价电子排布为3d64s2,C的价电子排布为2s22p2,N的价电子排布为2s22p3;非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构;
(2)C≡N中含1个σ键、2个π键,HCN的结构式为H-C≡N;
(3)熔点为253K,沸点为为376K,可知熔沸点低;
(4)图a中Fe原子处于顶点与体心,是体心立方堆积,图b中Al原子处于顶点与面心,属于面心立方最密堆积,以此来解答。
(1)基态K原子核外电子排布简写式为[Ar]4s1,K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是Fe,各元素的第一电离能由大到小的顺序为N>C>Fe>K,故答案为:[Ar]4s1;Fe;N>C>Fe>K;
(2)(CN)2的结构式为N ≡C一C≡N,存在碳碳单键,则分子中σ键有3个,π键有4个,σ键与π键数目之比为3:4; 故答案为:3:4;
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为为376K,其固体属于分子晶体;
(4)①铁的a堆积方式为体心立方堆积,与一个铁原子最近的铁原子距离为立方体边长的![]() ,这样的原子有八个,所以铁的配位数为8;如图所示:
,这样的原子有八个,所以铁的配位数为8;如图所示:
 ,晶胞中铁原子数为:8×
,晶胞中铁原子数为:8×![]() +1×=2,体心立方晶胞中r=
+1×=2,体心立方晶胞中r=![]() ,所以铁原子总体积=2×
,所以铁原子总体积=2×![]() =2×
=2× =
=![]() ,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为
,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为![]() 。
。
②②铝的b堆积方式为面心立方堆积,晶胞中含有Al原子数为:8×![]() +6×
+6×![]() =4,则晶胞质量为:
=4,则晶胞质量为:![]() g;该晶胞结构侧面可用如图表示:
g;该晶胞结构侧面可用如图表示: ,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=
,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=![]() r×10-10,所以晶胞体积为:(
r×10-10,所以晶胞体积为:(![]() r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为:
r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为:![]() g÷(
g÷(![]() r×10-10)3cm3=
r×10-10)3cm3=![]() g·cm-3。
g·cm-3。