题目内容
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>④>①D.氢原子个数①>③>④>②
【答案】C
【解析】
①6.72LCH4的物质的量n=![]() =6.72L÷22.4L/mol=0.3mol;
=6.72L÷22.4L/mol=0.3mol;
②3.01×1023个HCl的物质的量n=![]() =3.01×1023÷6.02×1023/mol=0.5mol;
=3.01×1023÷6.02×1023/mol=0.5mol;
③13.6gH2S的物质的量n=13.6g÷34g/mol=0.4mol;
④0.2molNH3。
A.根据V=n·Vm知,相同条件下体积之比等于物质的量之比,所以体积②>③>①>④,A正确,不符合题意;
B.根据ρ=![]() 可知,相同条件下,气体的密度之比等于摩尔质量之比,所以气体的密度关系为②>③>④>①,B正确,不符合题意;
可知,相同条件下,气体的密度之比等于摩尔质量之比,所以气体的密度关系为②>③>④>①,B正确,不符合题意;
C.根据m=n·M知,甲烷质量m(CH4)=0.3mol×16g/mol=4.8g,HCl的质量m(HCl)=0.5mol×36.5g/mol=18.25g,氨气的质量m(NH3)=0.2mol×17g/mol=3.4g,故气体的质量关系②>③>①>④,C错误,符合题意;
D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol×1=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故四种气体中的H原子数目①>③>④>②,D正确,不符合题意;
故合理选项是C。

 口算能手系列答案
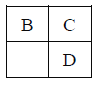
口算能手系列答案【题目】下列各物质中,不能够按照![]() (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
物质 选项 | a | b | c |
A | Na | Na2O2 | NaCl |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | FeO | Fe(NO3)2 | Fe(OH)2 |
D | CuO | CuSO4 | Cu(OH)2 |
A. AB. BC. CD. D