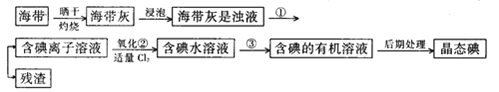
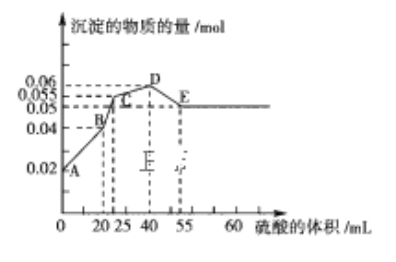
题目内容
【题目】Na2O和Na2O2组成的固体混合物溶于一定量的水中,充分反应后,收到标准状况下的气体1.12L,同时得到0.6molNaOH,求:
(1)原固体混合物中Na2O和Na2O2各是多少克?___、___
(2)所得溶液中应加入1mol/L的硫酸溶液多少毫升才能完全中和?___
【答案】7.8g 12.4g 300mL
【解析】
Na2O和Na2O2组成的固体混合物溶于一定量的水中,二者均可与水反应生成氢氧化钠,且Na2O2与水反应还生成O2,因此标准状况下1.12L的气体为Na2O2反应放出的O2,物质的量为![]() =0.05mol,可计算出Na2O2和Na2O2反应生成的NaOH的物质的量,进一步计算Na2O和Na2O反应生成的NaOH的物质的量,据此作答。
=0.05mol,可计算出Na2O2和Na2O2反应生成的NaOH的物质的量,进一步计算Na2O和Na2O反应生成的NaOH的物质的量,据此作答。
标准状况下1.12L的气体为Na2O2反应放出的O2,物质的量为![]() =0.05mol,可知n(Na2O2)=0.1mol,Na2O2反应生成的NaOH的物质的量为0.2mol,混合物共生成0.6molNaOH,因此Na2O反应生成的NaOH的物质的量为0.6-0.2=0.4mol, Na2O的物质的量为0.2mol;
=0.05mol,可知n(Na2O2)=0.1mol,Na2O2反应生成的NaOH的物质的量为0.2mol,混合物共生成0.6molNaOH,因此Na2O反应生成的NaOH的物质的量为0.6-0.2=0.4mol, Na2O的物质的量为0.2mol;
(1)m(Na2O2)=0.1mol×78g/mol=7.8g;m(Na2O)=0.2mol×62g/mol=12.4g;
(2)氢氧化钠与硫酸发生中和反应,且n(H2SO4)=![]() n(NaOH)=
n(NaOH)=![]() ×0.6mol=0.3mol,所以消耗硫酸的体积V=
×0.6mol=0.3mol,所以消耗硫酸的体积V=![]() =
=![]() =0.3L=300ml。
=0.3L=300ml。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目