题目内容
【题目】T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
(1)从0~2s该反应的平均速率v(NO2)=__。
(2)T1温度时化学平衡常数K=__L·mol-1。
(3)化学平衡常数K与速率常数k正、k逆的数学关系是K=__。若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=”)。
【答案】0.0875mol/(L·s) 8 ![]() >
>
【解析】
(1)根据表中数据计算出前2s内v(NO2)= 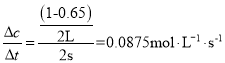 ;
;
(2)建立平衡时,反应三段式为:

根据化学平衡常数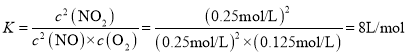 ;
;
(3)2NO(g)+O2(g)2NO2(g)化学平衡常数 ,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则
,化学反应达到平衡时v正=v逆,即k正c2(NO)c(O2)=k逆c2(NO2),则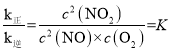 ,即
,即![]() ;温度改变为T2时其k正=k逆,则T2时化学平衡常数K=1,小于T1温度时的化学平衡常数,即T1→T2时,平衡逆向移动,而2NO(g)+O2(g)2NO2(g)△H<0,所以温度改变是升高温度, T2>T1,故答案为:
;温度改变为T2时其k正=k逆,则T2时化学平衡常数K=1,小于T1温度时的化学平衡常数,即T1→T2时,平衡逆向移动,而2NO(g)+O2(g)2NO2(g)△H<0,所以温度改变是升高温度, T2>T1,故答案为:![]() ;>。
;>。

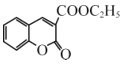
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
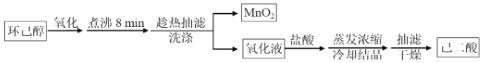
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
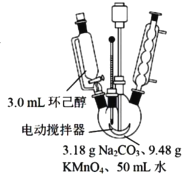
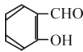
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点 232 ℃)与 Cl2反应制备 SnCl4,装置如图。

已知:①SnCl2、SnCl4 有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4 极易水解生成 SnO2·xH2O。回答下列问题:
(1)导管 a 的作用是_____,装置 A 中发生反应的离子方程式为_____。
(2)当观察到装置 F 液面上方_____时才开始点燃 D 处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________;②_____。
(3)若上述装置中缺少装置 C( 其它均相同) ,则D处具支试管中发生的主要副反应化学方程式为_____。
(4)Cl2和锡的反应产物有 SnCl4 和 SnCl2,为防止产品中带入过多的 SnCl2,可使用的温度范围是_____。
(5)滴定分析产品中 Sn(Ⅱ)的含量:用分析天平称取 5.000g 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用 0.1000 mol·L-1 的碘标准溶液滴定至终点时消耗 20.00 mL,则产品中 Sn(Ⅱ)的含量为_____。(已知 Sn2++I2=2I-+Sn4+)