题目内容
【题目】25℃时,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是
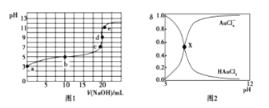
A. b点溶液中存在关系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)
B. X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C. c点溶液中存在关系:c(Na+)=c(AuCl4-)
D. d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
【答案】B
【解析】
A.b点溶液为物质的量浓度相等的HAuCl4和NaAuCl4混合溶液,由电子守恒可知2c(H+)+2c(Na+)=2c(OH-)+ 2c(AuCl4-)①,由物料守恒可知:2c(Na+) =c(AuCl4-)+c(HAuCl4)②,由①-②得2c(H+)+c(HAuCl4)=2c(OH-)+c(AuCl4-),故A正确;
B.由题图1可知,起始20mL0.1mol·L-1HAuCl4溶液的pH=3,说明酸为弱酸,b点酸恰好反应掉一半,pH=5,说明酸的电离程度大于其酸根离子的水解程度,则b点两种含氯微粒的物质的量分数不可能相等,故B错误。
C.c点溶液的pH=7,根据电荷守恒可知,c(Na+)=c(AuCl4-),故C正确;
D.d点时,HAuCl4与NaOH恰好完全反应,此时溶液的溶质为NaAuCl4,AuCl4-水解,溶液显碱性,所以c(Na+)>c(AuCl4-)>c(OH-)>c(H+),故D正确。
故选B。

 阅读快车系列答案
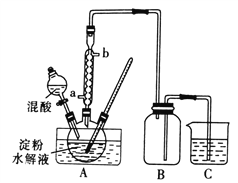
阅读快车系列答案【题目】下列实验装置示意图、实验现象及结论均正确的是
A | B | |
实验 |
|
|
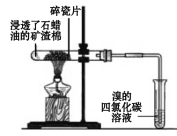
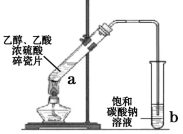
现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 |
结论 | 石蜡油分解产物中仅含有烯烃 | 反应生成难溶于饱和碳酸钠溶液的乙酸乙酯 |
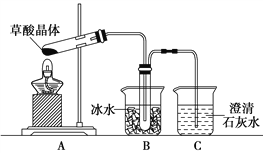
C | D | |
实验 |
|
|
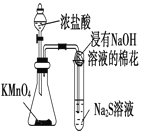
现象 | 试管中有淡黄色沉淀产生 | 反应过程中钠未熔化成小球 |
结论 | 非金属性Cl>S | 反应吸热 |
A. AB. BC. CD. D