题目内容
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

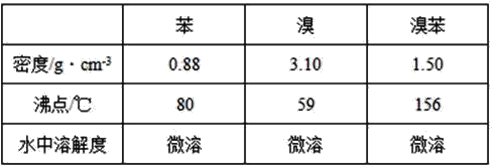
按以下合成步骤回答问题:
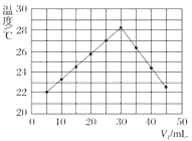
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了_____气体,继续滴加至液溴滴完,装置d的作用是______。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑。
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤,NaOH溶液洗涤的作用是_____。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是_____。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母)。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是_____(填入正确选项前的字母):
A. 25 mL B.50 mL C. 250 mL D. 500 mL
【答案】HBr 吸收HBr和Br2 除去HBr和未反应的Br2 干燥溴苯 苯 C B
【解析】
(1)实验室合成溴苯是苯与液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢;
(2)根据溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也不溶于水,分液后,然后加干燥剂;
(3)粗苯中混有苯,可蒸馏分离;
(4)根据制取溴苯所加的液体的体积以及溶液的体积一般不超容器的![]() ,不少于
,不少于![]() 来解答。
来解答。
(1)实验室合成溴苯是苯与液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和HBr,HBr极易溶于水呈白雾;液溴易挥发,而苯的卤代反应是放热反应,所以尾气中有HBr及挥发出的未反应的Br2,利用HBr、Br2都可以与NaOH反应的性质,用氢氧化钠溶液吸收,防止污染大气;
(2)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2反应变为NaBr和NaBrO,及其中溶解的少量HBr反应形成NaBr而进入到水中,然后加干燥剂,无水氯化钙能干燥溴苯,所以NaOH溶液洗涤的作用是:除去HBr和未反应的Br2,无水氯化钙的作用是除去溴苯中少量水,干燥溴苯;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,可根据苯、溴苯是互溶的、沸点不同的液体混合物,用蒸馏的方法分离,故合理选项是C;
(4)操作过程中,先在a中加入15 mL无水苯,在b中小心加入4.0 mL液态溴,共约19mL,步骤(1)完成后还要在a中加入10mLH2O,根据仪器使用要求:溶液的体积一般不超容器的![]() ,不少于
,不少于![]() ,所以a的容积最适合的是50mL,故合理选项是B。
,所以a的容积最适合的是50mL,故合理选项是B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
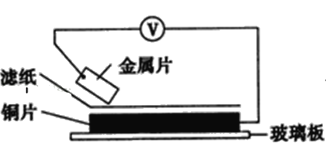
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极