题目内容
【题目】下列化学实验事实及其解释或结论都正确的是![]()
![]()
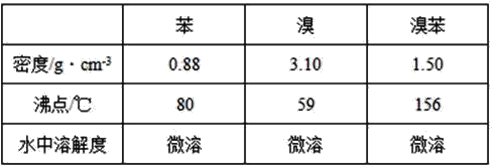
A.向浓度均为![]() 的
的![]() 、
、![]() 混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明
混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明![]()
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有![]()
C.向![]() 溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
D.某待测溶液可能含有等浓度的下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有
。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有![]() 、
、![]() ,需通过焰色反应确定
,需通过焰色反应确定
【答案】C
【解析】
A.向浓度均为![]() 的
的![]() 、
、![]() 混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明氢氧化铜更难溶,则
混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明氢氧化铜更难溶,则![]() ,故A错误;
,故A错误;
B.加入适量新制氯水,再加几滴KSCN溶液,溶液变红,若原溶液中存在铁离子,也会使溶液变红色,不一定含有亚铁离子,故B错误;
C.四氯化碳层呈紫色可知含碘,则向![]() 溶液中加入KI溶液,发生氧化还原反应生成CuI和碘,故C正确;
溶液中加入KI溶液,发生氧化还原反应生成CuI和碘,故C正确;
D.加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则一定含![]() 、
、![]() ,不含
,不含![]() 、
、![]() 、
、![]() ,因浓度相等,由电荷守恒可知一定含
,因浓度相等,由电荷守恒可知一定含![]() 、
、![]() ,溶液中不存在
,溶液中不存在![]() 、
、![]() ,故D错误;
,故D错误;
故答案选C。

【题目】关于有机反应类型的以下判断不正确的是( )
选项 | 有机反应 | 反应类型 |
A | 苯与H2反应生成环己烷 | 加成反应 |
B | 甲烷与氯气混合光照爆炸 | 取代反应 |
C | 乙烯与溴的CCl4溶液反应 | 取代反应 |
D | 乙烯使酸性高锰酸钾溶液褪色 | 氧化反应 |
A.AB.BC.CD.D
【题目】某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
回答下列问题:
(1)正确操作步骤的顺序是(用字母序号填写)_________。
(2)排去碱式滴定管中气泡的方法应采用下图操作中的________(填标号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定过程中,眼睛应注视______________。
(4)判断到达滴定终点的实验现象是__________________。
(5)数据记录如下:
滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
根据上述数据,可计算出该盐酸的浓度约为_____________(保留小数点后两位数)。
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有_____(填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管尖嘴部分有气泡,滴定后消失
D.滴定终点读数时俯视读数
E.滴定终点读数时仰视读数