题目内容
结合下图判断,下列叙述正确的是( )
| A.Ⅰ和Ⅱ中正极均保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
A
解析

练习册系列答案
相关题目
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(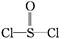 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
电解100 mL含c(H+)=0.30 mol·L-1下列溶液,当电路中通过0.04 mol
电子时,理论上析出金属质量最大的是( )
| A.0.10 mol·L-1AgNO3溶液 |
| B.0.10 mol·L-1ZnSO4溶液 |
| C.0.20 mol·L-1CuCl2溶液 |
| D.0.20 mol·L-1Pb(NO3)2溶液 |
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一
定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13 mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液的pH=13.0 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是SO2+2H2O-2e-=SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 |
随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( )。
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等金属离子对土壤和水源的污染 |
| C.不使电池中渗泄的电解液腐蚀其他的物品 |
| D.回收其中的石墨电极 |
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是 ( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
