题目内容
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是 ( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
D
解析

练习册系列答案
相关题目
结合下图判断,下列叙述正确的是( )
| A.Ⅰ和Ⅱ中正极均保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )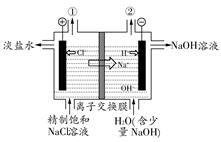
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )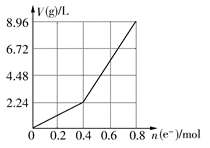
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月。其电池反应为:2CH3OH+3O2+4OH- 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32—+6H2O |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块如图所示放置一段时间。下列有关描述错误的是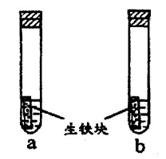
| A.生铁块中的碳是原电池的正极 |
| B.a试管内压强变大,b试管内压强变小 |
C.两试管中相同的电极反应式是:2Fe Fe2++2e- Fe2++2e- |
| D.两试管中均发生了电化腐蚀 |
以下现象与电化学腐蚀无关的是 ( )。
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
如图,缠上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在金属条表面的溶液出现粉红色。该金属条可能是 ( )。
| A.铜 | B.镁 | C.铝 | D.锌 |
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
| A.正极附近SO42-浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极反应式为Zn-2e-=Zn2+ |
| D.该原电池工作过程中电解质溶液的pH增大 |