题目内容
11.已知下列热化学方程式:Zn(s)+O2(g)═ZnO(s)△H=-Q1 kJ/mol
Hg(l)+O2(g)═HgO(s)△H=-Q2kJ/mol
Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H=-Q3kJ/mol
Q3值为( )
| A. | Q2-Q1 | B. | Q1+Q2 | C. | Q1-Q2 | D. | -Q1-Q2 |
分析 已知热化学方程式:①Zn(s)+O2(g)═ZnO(s)△H=-Q1 kJ/mol、②Hg(l)+O2(g)═HgO(s)△H=-Q2kJ/mol,根据盖斯定律①-②得:Zn(s)+HgO(s)═ZnO(s)+Hg(1),据此计算出Q3.
解答 解:由①Zn(s)+O2(g)═ZnO(s)△H=-Q1 kJ/mol,
②Hg(l)+O2(g)═HgO(s)△H=-Q2kJ/mol,
则根据盖斯定律可知,①-②得Zn(s)+HgO(s)═ZnO(s)+Hg(1),
所以△H=-Q3=-Q1-(-Q2)=Q2-Q1,即:Q3=Q1-Q2,
故选C.
点评 本题考查学生利用盖斯定律计算反应热,题目难度不大,关键在于构造反应过程,注意掌握盖斯定律的概念及应用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
1.天然提取和人工合成的物质往往是混合物,确定其中指定有机物分子结构的步骤是( )
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
2.绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求.理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物、实现零排放.下列几种生产乙苯(C6H5-C2H5)的方法中,原子经济性最好的是( )
| A. | C6H6+C2H5Cl→C6C5-C2H5+HCl | |
| B. | C6H6+C2H5OH→C6H5-C2H5+H2O | |
| C. | C6H6+CH2=CH2→C6H5-C2H5 | |
| D. | C6H5-CH2CH2Br→C6H5-CH=CH2+HBr;C6H5-CH=CH2+H2→C6H5C2H5 |
19.下列实验操作正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中去除金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的碳酸钠溶液1000mL | 准确称取碳酸的固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀、定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 去除分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出至截面上,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端放出 |
| A. | A | B. | B | C. | C | D. | D |
6. 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
①正向反应的反应热△H>0(“>”“<”“=”);
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
16. 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )| A. | 14.4 | B. | 10.4 | C. | 12.4 | D. | 14.0 |
3.下列说法正确的是( )
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. | 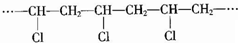 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 按系统命名法,化合物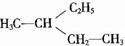 的名称为2-乙基丁烷 的名称为2-乙基丁烷 |
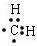 ;
;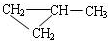 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
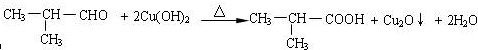 ;
; .
.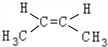 、
、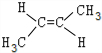 .
.