题目内容
16. 电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为a克,则a值为( )| A. | 14.4 | B. | 10.4 | C. | 12.4 | D. | 14.0 |
分析 根据图知,右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,左侧电极反应式为2H2O-4e-=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差,据此分析解答.
解答 解:根据图知,右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,左侧电极反应式为2H2O-4e-=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差,若电解过程中转移了2mol电子,左侧减少质量=$\frac{2mol}{4}×2×18g/mol$=18g,左侧有4mol氢离子进入右侧,右侧减少质量=$\frac{2mol}{10}×1×28g/mol$-$\frac{2mol}{4}×4×1g/mol$=3.6g,所以膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,故选A.
点评 本题考查电解原理,侧重考查学生分析计算能力,明确右侧中减少质量实质是解本题关键,注意左侧生成的氢离子进入右侧溶液,所以导致右侧溶液减少质量不是氮气质量,为易错点.

练习册系列答案
相关题目
6.已知:
HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ•mol-1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-b kJ•mol-1,
则a、b 二者的大小关系为( )
HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ•mol-1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-b kJ•mol-1,
则a、b 二者的大小关系为( )
| A. | a>b | B. | b>a | C. | a=b | D. | 无法判断 |
4.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )


| A. | X的某种单质是一种新型自来水消毒剂 | |
| B. | 简单离子半径:W->R2->X2->S3+ | |
| C. | R、Z不可能形成离子化合物 | |
| D. | 字母所代表的元素中最高价氧化物的水化物酸性最强的是Y |
11.已知下列热化学方程式:
Zn(s)+O2(g)═ZnO(s)△H=-Q1 kJ/mol
Hg(l)+O2(g)═HgO(s)△H=-Q2kJ/mol
Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H=-Q3kJ/mol
Q3值为( )
Zn(s)+O2(g)═ZnO(s)△H=-Q1 kJ/mol
Hg(l)+O2(g)═HgO(s)△H=-Q2kJ/mol
Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H=-Q3kJ/mol
Q3值为( )
| A. | Q2-Q1 | B. | Q1+Q2 | C. | Q1-Q2 | D. | -Q1-Q2 |
1.下列说法正确的是( )
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |
8.下列方法或操作正确且能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 鉴别二甲醚和乙醇 | 利用质谱法 |
| ③ | 检验乙醇在浓硫酸催化下的消去产物 | 将产物通入酸性KMnO4溶液 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液 |
| ⑤ | 鉴别苯、四氯化碳、丙醛 | 分别滴加溴水 |
| A. | ①⑤ | B. | ②③ | C. | ①④⑤ | D. | ②③④ |
5.下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+). |
6.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
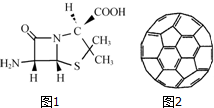 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.