题目内容
【题目】镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(s)△H1=﹣74.5kJmol﹣1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=﹣64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJmol﹣1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl26H2O转化为MgCl2NH4ClnNH3 , 然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;
(3)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)26H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100molL﹣1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.产品中Mg(ClO3)26H2O的纯度为(用百分号表示,精确到小数点后一位)
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如1图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是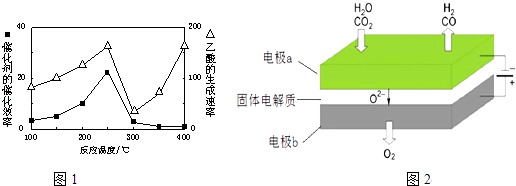
(5)Li2O、Na2O、MgO均能吸收CO2 .
①如果寻找吸收CO2的其它物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4 , Li4SiO4用于吸收、释放CO2 , 原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2 , Li4SiO4再生,说明该原理的化学方程式是
(6)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
【答案】
(1)+213.4
(2)MgCl2?NH4Cl?nNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑
MgCl2+(n+1)NH3↑+HCl↑
(3)78.3%
(4)温度超过250℃时,催化剂的催化效率降低
(5)ab;CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3
Li2CO3+Li2SiO3
(6)CO2+2e﹣═CO+O2﹣
【解析】解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJmol﹣1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②﹣2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol﹣2×(﹣74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
所以答案是:213.4;(2)MgCl2NH4ClnNH3 , 在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2NH4ClnNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑;所以答案是:MgCl2NH4ClnNH3
MgCl2+(n+1)NH3↑+HCl↑;所以答案是:MgCl2NH4ClnNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑;(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O,根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+ , Cr2O72﹣~6Fe2+ , 用0.100molL﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000molL﹣1﹣0.009mol=0.011mol,
MgCl2+(n+1)NH3↑+HCl↑;(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O,根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+ , Cr2O72﹣~6Fe2+ , 用0.100molL﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000molL﹣1﹣0.009mol=0.011mol,
氯酸根离子的物质的量为: ![]() ×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)26H2O的质量分数:( ![]() ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ![]() ×100%=78.3%,所以答案是:78.3%;(4)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;(5)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2 , 可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;b.Li2O、Na2O、MgO均能吸收CO2 , 钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;c.Li2O、Na2O、MgO均能吸收CO2 , 但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;所以答案是:ab;②在500℃,CO2与Li4SiO4接触后生成Li2CO3 , 反应物为CO2与Li4SiO4 , 生成物有Li2CO3 , 根据质量守恒可知产物还有Li2SiO3 , 所以化学方程式为:CO2+Li4SiO4
×100%=78.3%,所以答案是:78.3%;(4)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;(5)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2 , 可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;b.Li2O、Na2O、MgO均能吸收CO2 , 钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;c.Li2O、Na2O、MgO均能吸收CO2 , 但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;所以答案是:ab;②在500℃,CO2与Li4SiO4接触后生成Li2CO3 , 反应物为CO2与Li4SiO4 , 生成物有Li2CO3 , 根据质量守恒可知产物还有Li2SiO3 , 所以化学方程式为:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3 ,
Li2CO3+Li2SiO3 ,
所以答案是:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3;(6)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣ .
Li2CO3+Li2SiO3;(6)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣ .

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案