题目内容
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( ) 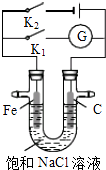
A.K1闭合,铁棒上发生的反应为2H++2e﹣→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
【答案】C
【解析】解:A、若闭合K1 , 该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe﹣2e﹣=Fe2+ , 故A错误; B、若闭合K1 , 该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣ , 所以石墨棒周围溶液pH逐渐升高,故B错误;
C、K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法,故C正确;
D、K2闭合,电路中通过0.4NA个电子时,阴极生成0.2mol氢气,阳极生成0.2mol氯气,两极共产生0.4mol气体,状况不知无法求体积,故D错误.
故选C.

【题目】碘硫化学循环原理如图1所示.
(1)写出反应③的化学方程式 , 一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K= .
(2)写出反应①的化学方程式 , 其中SO2体现的是性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是 .
(4)氧缺位铁酸铜(CuFe2O4﹣δ)是反应②的良好的催化剂.实验室用如下方法制得:Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4 , 得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式
②研究发现:
温度 | 元素存在形式 |
1200﹣1350K | Fe3+部分转变为Fe2+ |
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 .
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式 . 请用文字说明在N极能够获得所需物质的原因是 .