题目内容
4.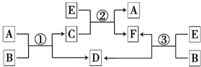 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的化学式分别为Br2、I2、Cl2.
(2)若B是水,C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物,D是相同条件下密度最小的气体,E是一种无色、无味的有毒气体,则反应①的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)若B为一种淡黄色固体.绿色植物的光合作用和呼吸作用可实现自然界中D和E 的循环.则反应①的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
在反应③中,若生成1mol D,则转移电子的物质的量为2mol;反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2.
分析 (1)A、D、E为卤素单质,反应①②③均为水溶液中的置换反应,结合框图转化关系可知,A发生置换生成D,E发生置换生成D,同时E发生置换生成A,所以A为Br2,D为I2,E为Cl2,B为NaI、C为NaBr、F为NaCl;
(2)若B是水,C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物,则A为Fe,C为四氧化三铁,D为氢气,E是一种无色、无味的有毒气体,由转化关系可知,E为CO,F为二氧化碳;
(3)绿色植物的光合作用和呼吸作用能实现自然界中D和E的循环,则D和E分别是CO2 和O2 的一种,B是淡黄色固体,由反应③可知E和B反应生成D,可以推断B是Na2O2、E是CO2、D是O2、F为Na2CO3,结合转化关系可推知,A为H2O,C为NaOH.
解答 解:(1)A、D、E为卤素单质,反应①②③均为水溶液中的置换反应,结合框图转化关系可知,A发生置换生成D,E发生置换生成D,同时E发生置换生成A,所以A为Br2,D为I2,E为Cl2,B为NaI、C为NaBr、F为NaCl,
故答案为:Br2;I2;Cl2;
(2)若B是水,C是生产生活中应用最广泛的金属所对应的一种具有磁性的黑色氧化物,则A为Fe,C为四氧化三铁,D为氢气,E是一种无色、无味的有毒气体,由转化关系可知,E为CO,F为二氧化碳,反应①的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)绿色植物的光合作用和呼吸作用能实现自然界中D和E的循环,则D和E分别是CO2 和O2 的一种,B是淡黄色固体,由反应③可知E和B反应生成D,可以推断B是Na2O2、E是CO2、D是O2、F为Na2CO3,结合转化关系可推知,A为H2O,C为NaOH,则反应①的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,反应③为2Na2O2+2CO2=2Na2CO3+O2,生成1molO2转移的电子数目为1mol×2×[0-(-1)]=2 mol,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;2 mol;2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查无机物的推断,题目较为综合,注意把握物质的转化关系以及反应的典型现象,难度中等,掌握元素化合物的性质是关键.

| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
| A. | 常温下,22g CO2含有2NA个氧原子 | |
| B. | 标准状况下,22.4L的CCl4中含有的分子数为NA | |
| C. | 1mol/L的碳酸钠溶液中含Na+离子数为2NA | |
| D. | 常温下,将含0.1NA个HCl分子的氯化氢气体溶于水配成100mL溶液,所得溶液中C(H+)为1mol/L |

