题目内容
12.(1)FeCl3的水溶液呈酸性(填“酸”、“碱”或“中”),原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+,实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以抑制(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3;原因是(用方程式表示)Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;(2)将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,若溶液中 c(CH3COO-)=c(Na+),则混合后溶液呈中(填“酸“‘碱”或“中”)性,醋酸与氢氧化钠溶液体积大小关系是V(NaOH)<V(CH3COOH)(填“>”“=”或“<”).
分析 (1)FeCl3是强酸弱碱盐,Fe3+水解导致溶液呈酸性;为防止Fe3+水解,在配制氯化铁溶液时要加入少量浓盐酸抑制其水解;FeCl3水解生成HCl,HCl具有挥发性,从而促进水解,水解生成的Fe(OH)3灼热易分解生成Fe2O3和水;
(2)混合溶液中存在 c(CH3COO-)=c(Na+),任何电解质溶液中都存在电荷守恒,根据电荷守恒判断溶液中 c(OH-)、c(H+)相对大小,CH3COONa溶液呈碱性,要使混合溶液呈中性,则CH3COOH的物质的量应该稍微大些.
解答 解:(1)FeCl3是强酸弱碱盐,Fe3+水解导致溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;为防止Fe3+水解,在配制氯化铁溶液时要加入少量浓盐酸抑制其水解;FeCl3水解生成HCl,HCl具有挥发性,从而促进水解,水解生成的Fe(OH)3灼热易分解生成Fe2O3和水,所以最终得到的固体是Fe2O3,涉及的化学方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+、2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
故答案为:酸; Fe3++3H2O?Fe(OH)3+3H+;抑制; Fe2O3;Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(2)混合溶液中存在 c(CH3COO-)=c(Na+),任何电解质溶液中都存在电荷守恒,根据电荷守恒得溶液中 c(OH-)=c(H+),CH3COONa溶液中醋酸根离子水解导致溶液呈碱性,要使混合溶液呈中性,则CH3COOH的物质的量应该稍微大些,二者浓度相等,则V(NaOH)<V(CH3COOH),
故答案为:中;<.
点评 本题考查酸碱混合溶液定性判断、盐类水解等知识点,为高频考点,明确盐特点是解本题关键,注意:蒸干灼烧盐溶液时,如果是挥发性酸形成的盐,最终得到的是金属氧化物,如果是难挥发性酸形成的盐,最终得到的是物质本身,如果是不稳定酸形成的盐,蒸干灼烧过程中物质可能发生氧化还原反应或分解反应.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案| A. | CH2═CH2 | B. | CH2═CH-CH2CH3 | C. | 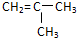 | D. | CH2═CH-CH═CH2 |
| A. | CO2和N2 | B. | CO2和NO2 | C. | CO2和O2 | D. | CO2、N2和O2 |
| A. | 将固体CuO加入稀H2SO4中 CuO+2H+=Cu2++H2O | |
| B. | 盐酸滴加在石灰石上 CaCO3+2H+=Ca2++H2CO3 | |
| C. | Ba(OH)2溶液与稀硫酸混合 Ba2++SO42-=BaSO4↓ | |
| D. | 铜片加入稀盐酸中 Cu+2H+=Cu2++H2↑ |
 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答: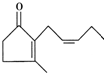 茉莉酮是一种人工合成的香料,其结构简式如图所示:
茉莉酮是一种人工合成的香料,其结构简式如图所示: