题目内容
3.“绿色奥运”是2008北京奥运会的主题之一.为减轻污染,北京市为汽车加装了“三元催化净化器”,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体,该混合气体是( )| A. | CO2和N2 | B. | CO2和NO2 | C. | CO2和O2 | D. | CO2、N2和O2 |
分析 根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前各原子的数目之和等于反应后各原子的数目之和,反应物为NO、CO,则产物也由氮、碳、氧三种元素组成,转化为参与大气循环的无毒混合气体,所以该反应为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,据此分析解答.
解答 解:A.由题意可知反应物是CO和NO,即反应物中含有C、N、O三种元素,生成物中也必须只能含有C、N、O三种元素,“三效催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒混合气体,所以该反应为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故A正确;
B.二氧化氮为有毒气体,且为大气污染物,故B错误;
C.二氧化碳和氧气,产物中没有N元素,不满足质量守恒定律,故C错误;
D.氧气的氧化性较强,不会被CO或NO氧化生产氧气,故D错误;
故选A.
点评 本题主要考查大气污染物及其治理方法,题目难度不大,明确质量守恒定律及氧化还原反应中化合价变化规律为解答关键,注意掌握氮、碳的单质及其氧化物的性质.

练习册系列答案
相关题目
13.2.2g某化合物中含有3.01×1022个甲分子,则甲的摩尔质量为( )
| A. | 44g/mol | B. | 2.2mol | C. | 44g | D. | 22 |
14.常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH${\;}_{4}^{+}$):c(NO${\;}_{3}^{-}$)=1:1,可以采取的下列措施是( )
| A. | 加入适量的HNO3,抑制NH${\;}_{4}^{+}$水解 | B. | 加入适量的氨水,使溶液的pH等于7 | ||
| C. | 再加入适量的NH4NO3(s) | D. | 加入适量的NaOH,使溶液的pH等于7 |
11.对于锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( )
| A. | Zn是正极 | B. | 电子由铜片经外电路流向锌片 | ||
| C. | Zn-2e-═Zn2+ | D. | 溶液中H+向锌片迁移 |
8.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被氧化 |
15.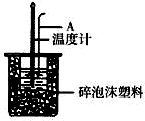 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如右图所示,仪器A的名称是环形玻璃搅拌棒;大小烧瓶间填满泡沫塑料的作用减少实验过程中的热量损失.
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3kJ/(g•℃).
为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ/mol;(结果保留一位小数)
(4)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的.
 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如右图所示,仪器A的名称是环形玻璃搅拌棒;大小烧瓶间填满泡沫塑料的作用减少实验过程中的热量损失.
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3kJ/(g•℃).
为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1℃ | 终止温度t1℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(4)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的.