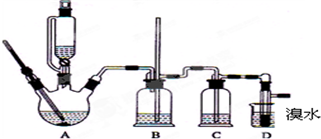
题目内容
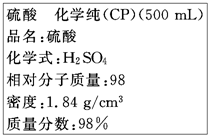 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:(1).则该硫酸的物质的量浓度为
(2).某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol?L-1的稀H2SO4,现取上述浓硫酸稀释配制稀硫酸,则所需实验仪器有
(3)下面是某学生的操作过程:
a.将浓硫酸倒入另一个盛有适量蒸馏水的烧杯中稀释,并冷却到室温;
b.用量筒量取浓硫酸;
c.用玻璃棒引流,将稀释后的硫酸倒入已检查不漏水的容量瓶中;
d.将所得溶液倒入试剂瓶,在试剂瓶上贴上标签待用.
e.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
f.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1cm~2cm
g.洗涤烧杯和玻璃棒,并将洗涤液注入容量瓶.
正确的操作顺序是
(4)在配制4.6mol?L-1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:
②容量瓶用1mol?L-1的稀H2SO4润洗:
③定容时仰视液面读数:
④容量瓶有蒸馏水
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算该浓硫酸的物质的量浓度;
(2)根据操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作选择使用的仪器;
根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积;
(3)根据操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作确定顺序;
(4)根据c=
计算不当操作对n或V的影响.
| 1000ρω |
| M |
(2)根据操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作选择使用的仪器;
根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积;
(3)根据操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作确定顺序;
(4)根据c=
| n |
| V |
解答:
解:(1)该浓硫酸物质的量浓度为
mol/L=18.4mol/L,故答案为:18.4;
(2)操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作,用50mL量筒量取(用到胶头滴管)18.4mol/L的浓硫酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中(容量瓶没有240mL规格),并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以需要的仪器为:量筒,烧杯,玻璃棒,250ml容量瓶,胶头滴管;应配制溶液的体积为250mL,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×4.6mol/L,解得:x=62.5mL.
故答案为:量筒,烧杯,玻璃棒,250ml容量瓶,胶头滴管;62.5;
(3)操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等,所以正确的操作顺序是:bacgfed,故答案为:bacgfed;
(4)①未经冷却趁热将溶液注入容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,故答案为:偏高;
②容量瓶用1mol?L-1的稀H2SO4润洗,溶质的物质的量偏大,溶液的浓度偏高,故答案为:偏高;
③定容时仰视观察液面,导致加入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,故答案为:偏低;
③容量瓶中原有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,不影响配制结果,故答案为:无影响;
| 1000×1.84×98% |
| 98 |
(2)操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等操作,用50mL量筒量取(用到胶头滴管)18.4mol/L的浓硫酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中(容量瓶没有240mL规格),并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以需要的仪器为:量筒,烧杯,玻璃棒,250ml容量瓶,胶头滴管;应配制溶液的体积为250mL,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×4.6mol/L,解得:x=62.5mL.
故答案为:量筒,烧杯,玻璃棒,250ml容量瓶,胶头滴管;62.5;
(3)操作步骤有计算、量取、溶解冷却、移液、洗涤移液、定容、摇匀等,所以正确的操作顺序是:bacgfed,故答案为:bacgfed;
(4)①未经冷却趁热将溶液注入容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,故答案为:偏高;
②容量瓶用1mol?L-1的稀H2SO4润洗,溶质的物质的量偏大,溶液的浓度偏高,故答案为:偏高;
③定容时仰视观察液面,导致加入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,故答案为:偏低;
③容量瓶中原有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,不影响配制结果,故答案为:无影响;
点评:本题考查了一定物质的量浓度溶液的配制步骤以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
如图为铜锌原电池装置,下列叙述错误的是( )
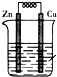

| A、Cu 片上有气泡产生 |
| B、电子由锌片通过导线流向铜片 |
| C、Zn片上发生氧化反应 |
| D、Cu片上发生氧化反应 |
下列反应的离子方程式正确的是( )
A、用石墨作电极电解CuCl2溶液:2Cl-+2H2O
| ||||
| B、用Na2CO3溶液作洗涤剂除油污:CO32-+2H2O═H2CO3+2OH- | ||||
| C、硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++2H2O2+4H+═Fe3++4H2O | ||||
| D、向NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
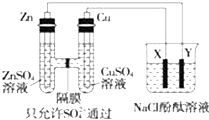 按如图所示装置连接,X、Y均为惰性电极.请回答下列问题:
按如图所示装置连接,X、Y均为惰性电极.请回答下列问题: