题目内容
下列反应的离子方程式正确的是( )
A、用石墨作电极电解CuCl2溶液:2Cl-+2H2O
| ||||
| B、用Na2CO3溶液作洗涤剂除油污:CO32-+2H2O═H2CO3+2OH- | ||||
| C、硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++2H2O2+4H+═Fe3++4H2O | ||||
| D、向NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.用石墨作电极电解CuCl2溶液反应生成铜和氯气;
B.碳酸根为多元弱酸的酸根离子分步水解;
C.电荷数、得失电子数不守恒;
D.向NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠.
B.碳酸根为多元弱酸的酸根离子分步水解;
C.电荷数、得失电子数不守恒;
D.向NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠.
解答:
解:A.用石墨作电极电解CuCl2溶液离子方程式为:2Cl-+Cu2+
Cu+Cl2↑,故A错误;
B.用Na2CO3溶液作洗涤剂除油污离子方程式为:CO32-+H2O?HCO3-+OH-,故B错误;
C.硫酸亚铁溶液与稀硫酸、双氧水混合反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故C错误;
D.向NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选:D.
| ||
B.用Na2CO3溶液作洗涤剂除油污离子方程式为:CO32-+H2O?HCO3-+OH-,故B错误;
C.硫酸亚铁溶液与稀硫酸、双氧水混合反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故C错误;
D.向NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,明确化学反应的实质是解题关键,注意A为易错选项,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列离子可以大量共存的是( )
| A、K+、SO42-、OH-、Cl- |
| B、Na+、Ag+、Cl-、NO3- |
| C、Ba2+、Na+、OH-、CO32- |
| D、Na+、NH4+、NO3-、OH- |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出].附图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件(所用条件均不同).已知t3~t4阶段使用催化剂.下列说法正确的是( )
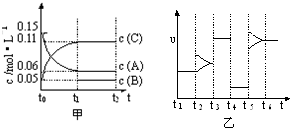

| A、t2~t3阶段的一定是增加反应物浓度 |
| B、t4~t5阶段改变的条件为降温或减压 |
| C、B的起始物质的量为0.02mol |
| D、该反应的化学方程式为:3A(g)?B(g)+2C(g) |
下列叙述中能证明次氯酸是一种弱酸的是( )
| A、次氯酸不稳定,易分解 |
| B、次氯酸是一种强氧化剂 |
| C、次氯酸钙能与碳酸作用生成碳酸钙和次氯酸 |
| D、次氯酸能使染料和有机色质褪色 |
下列有关说法正确的是( )
| A、水中存在电离平衡,向纯水中加酸或加入碱都抑制水的电离,加盐可以促进水的电离 |
| B、将0.2mol/L的NH3?H2O与0.1mol/L的HCl溶液等体积混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、常温下,0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) |
| D、在25℃时,除去水体中的Ba2+选择Na2CO3比Na2CrO4好[已知Ksp(BaCO3)>Ksp(BaCrO4)] |
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是( )
| 元素代号 | X | Y | Z | M | N |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A、X、Y最高价氧化物对应水化物的碱性:Y>X |
| B、M、N形成的简单离子的还原性:N->M- |
| C、气态氢化物的稳定性:HM<H2Z |
| D、最高价氧化物对应的水化物的酸性:H2ZO4>HNO4 |
下列说法中正确的是( )
A、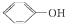 与 与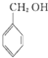 互为同系物 互为同系物 |
| B、乙醇和乙醚互为同分异构体 |
| C、可用浓溴水来区分乙醇和苯酚 |
| D、乙醇、乙二醇、丙三醇互为同系物 |
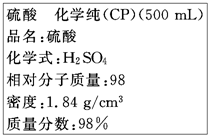 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: