题目内容
将32g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合合气体在标准状况下的体积为11.2L.请计算:
(1)NO、NO2的体积分别为多少升?
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为多少?(计算结果可以不化简)
(1)NO、NO2的体积分别为多少升?
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为多少?(计算结果可以不化简)
考点:硝酸的化学性质
专题:
分析:(1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(2)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=
计算.
(2)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=
| n |
| V |
解答:
解:(1)32g铜的物质的量为
=0.5mol,在反应中失去的电子的物质的量为2×0.5mol=1 mol,11.2L混合气体的物质的量为
=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:
,
解得x=0.25、y=0.25,
NO的体积=0.25mol×22.4L/mol=5.6L
NO2的体积=0.25mol×22.4L/mol=5.6L
答:NO的体积为5.6L,NO2的体积为5.6L;
(2)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=V×10-3L×amol/L=aV×10-3 mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=aV×10-3 mol+0.5mol=(aV×10-3+0.5)mol,故硝酸的物质的量浓度=
=
mol/L,
答:原硝酸溶液的浓度为
mol/L.
| 32g |
| 64g/mol |
| 11.2L |
| 22.4L/mol |
令NO和NO2的物质的量分别为xmol、ymol,则:
|
解得x=0.25、y=0.25,
NO的体积=0.25mol×22.4L/mol=5.6L
NO2的体积=0.25mol×22.4L/mol=5.6L
答:NO的体积为5.6L,NO2的体积为5.6L;
(2)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=V×10-3L×amol/L=aV×10-3 mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=aV×10-3 mol+0.5mol=(aV×10-3+0.5)mol,故硝酸的物质的量浓度=
| (aV×10-3+0.5)mol |
| 0.15L |
| (aV×10-3+0.5) |
| 0.15 |
答:原硝酸溶液的浓度为
| (aV×10-3+0.5) |
| 0.15 |
点评:本题考查化学方程式计算,难度中等,注意利用守恒思想进行解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、Cl2具有很强的氧化性,在化学反应中只能作氧化剂 |
| B、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
| C、实验室制备Cl2,可用排饱和食盐水集气法收集 |
| D、标准状况下11.2L Cl2与水反应转移2NA e-(NA表示阿伏伽德罗常数) |
下列有关说法正确的是( )
| A、水中存在电离平衡,向纯水中加酸或加入碱都抑制水的电离,加盐可以促进水的电离 |
| B、将0.2mol/L的NH3?H2O与0.1mol/L的HCl溶液等体积混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、常温下,0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) |
| D、在25℃时,除去水体中的Ba2+选择Na2CO3比Na2CrO4好[已知Ksp(BaCO3)>Ksp(BaCrO4)] |
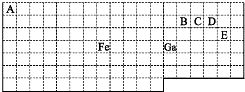 如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.
如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.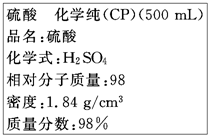 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: