题目内容
(1)书写下列物质水溶液中的电离方程式(CH3COOH,NaHSO4,NaHCO3,NH3?H20)
(2)某温度(t℃)时,水溶液中KW=10-13,则该温度 25℃,(填“<”“>”或“=”),将此温度下pH=1的硫酸溶液a L与pH=12的氢氧化钠溶液b L混合.
①若所得混合液为中性,则a:b= .
②若所得混合液的pH=2,则a:b= .
(2)某温度(t℃)时,水溶液中KW=10-13,则该温度
①若所得混合液为中性,则a:b=
②若所得混合液的pH=2,则a:b=
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)强电解质的电离用“=”,弱电解质的电离用“?”,电离遵循电荷守恒和质量守恒定律,并注意酸根离子不可拆分,以此来解答;
(2)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大;
①强酸和强碱混合溶液呈中性,说明酸中c(H+)等于碱中c(OH-);
②根据混合溶液中c(H+)=
计算.
(2)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大;
①强酸和强碱混合溶液呈中性,说明酸中c(H+)等于碱中c(OH-);
②根据混合溶液中c(H+)=
| n(H+)-n(OH-) |
| V(酸)+V(碱) |
解答:
解:(1)CH3COOH是弱电解质,电离方程式为CH3COOH?CH3COO-+H+,
NaHSO4为强电解质,电离方程式为NaHSO4═Na++H++SO42-;
NaHCO3为强电解质,电离方程式为NaHCO3═Na++HCO3-;
NH3?H2O为弱电解质,电离方程式为NH3?H2O?NH4++OH-,
故答案为:CH3COOH?CH3COO-+H+,NaHSO4═Na++H++SO42-,NaHCO3═Na++HCO3-,NH3?H2O?NH4++OH-;
(2)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,某温度时,水的离子积KW=1×10-13>×10-14,所以则该温度>25℃;故答案为:>;
①将此温度下pH=1的硫酸溶液a L与pH=12的氢氧化钠溶液b L混合,混合液为中性,则10-1×a=1012-13×b,所以
=
,故答案为:1:1;
②混合液的pH=2,可知:10-2=
,解得a:b=11:9,故答案为:11:9.
NaHSO4为强电解质,电离方程式为NaHSO4═Na++H++SO42-;
NaHCO3为强电解质,电离方程式为NaHCO3═Na++HCO3-;
NH3?H2O为弱电解质,电离方程式为NH3?H2O?NH4++OH-,
故答案为:CH3COOH?CH3COO-+H+,NaHSO4═Na++H++SO42-,NaHCO3═Na++HCO3-,NH3?H2O?NH4++OH-;
(2)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,某温度时,水的离子积KW=1×10-13>×10-14,所以则该温度>25℃;故答案为:>;
①将此温度下pH=1的硫酸溶液a L与pH=12的氢氧化钠溶液b L混合,混合液为中性,则10-1×a=1012-13×b,所以
| a |
| b |
| 1 |
| 1 |
②混合液的pH=2,可知:10-2=
| 10-1×a-10-1×b |
| a+b |
点评:本题考查电离方程式注意电解质的强弱的判断及pH的简单计算,明确基本的pH计算公式是解本题关键,题目难度不大.

练习册系列答案
相关题目
甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中不正确的是( )
| A、甲醇分子内C原子的杂化方式为sp3杂化 |
| B、甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
| C、甲醛分子内C原子上无孤对电子 |
| D、甲醛分子两个C-H键夹角小于120° |
下列离子可以大量共存的是( )
| A、K+、SO42-、OH-、Cl- |
| B、Na+、Ag+、Cl-、NO3- |
| C、Ba2+、Na+、OH-、CO32- |
| D、Na+、NH4+、NO3-、OH- |
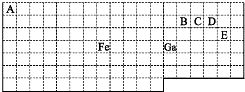 如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.
如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.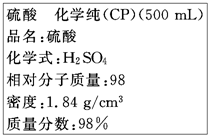 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: