题目内容
15.有一种抗酸药,其有效成分是CaCO3,为测定每一片药片中CaCO3的含量,现取一片药片,研成粉末,再与足量盐酸反应,收集到标准状况下的CO2气体22.4mL.则①CaCO3与足量盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
②每一片药片中CaCO3的质量为0.1g.
分析 发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,根据方程式计算碳酸钙物质的量,再根据m=nM计算碳酸钙质量.
解答 解:①碳酸钙与盐酸发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②标况下22.4mL 二氧化碳的物质的量为$\frac{0.0224L}{22.4L/mol}$=0.001mol
CaCO3+2HCl=CaCl2+H2O+CO2↑
1 1
n(CaCO3) 0.001mol
所以n(CaCO3)=$\frac{0.001mol×1}{1}$=0.001mol
故m(CaCO3)=0.001mol×100g/mol=0.1g
故答案为:0.1.
点评 本题考查化学方程式有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
3.已知某元素+3价离子的电子排布式为:1s22s22p63s23p63d3,该元素在周期表中的位置和区是( )
| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |
10.下列说法正确的是( )
| A. | 食盐水是电解质 | |
| B. | 氯化氢是电解质,所以液态氯化氢导电,气态氯化氢不导电 | |
| C. | CuSO4是电解质,CuSO4•5H2O不是电解质 | |
| D. | 蔗糖、乙醇等多数有机化合物和非金属氧化物都是非电解质 |
20.将一定量的NO和足量O2投入2L恒容密闭容器内,800℃时只发生的化学反应2NO(g)+O2(g)?2NO2(g),n(NO)随时间变化如下表:
(1)NO表示从0~2s内该反应的平均速率v(NO)=0.003 mol/(L•s)
(2)计算5s时NO2的物质的量浓度(要求写出计算过程)
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)计算5s时NO2的物质的量浓度(要求写出计算过程)
7.苯甲酸广泛应用于制药和化工行业,用甲苯制备苯甲酸的反应原理如下:
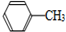 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$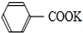 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
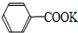 +HCl→
+HCl→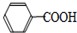 +KCl
+KCl
甲苯和KMnO4溶液在100℃反应一段时间后停止反应,分离出苯甲酸和回收未反应的甲苯流程如下

已知:苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;下列说法正确的是( )
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$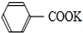 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl甲苯和KMnO4溶液在100℃反应一段时间后停止反应,分离出苯甲酸和回收未反应的甲苯流程如下

已知:苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;下列说法正确的是( )
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
4.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取
剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取
剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
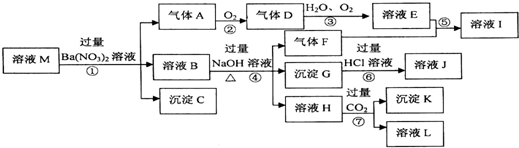
 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.