题目内容
1.将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如表数据:| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
分析 化学平衡常数等于平衡时生成物的浓度的幂之积比上反应物平衡浓度幂之积,根据三行式计算出各物质的平衡浓度,然后结合平衡常数的表达式计算.
解答 解:CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L) 2.0 0.8 0 0
转化(mol/L) 0.4 0.4 0.4 0.4
平衡(mol/L) 1.6 0.4 0.4 0.4
K=$\frac{0.4×0.4}{1.6×0.4}$=0.25,
故答案为:0.25.
点评 本题主要考查化学平衡常数计算以及应用平衡常数计算平衡时有关物质的物质的量,解题关键是要抓住温度不变化学平衡常数也不变,题目难度不大.

练习册系列答案
相关题目
12.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl- |
9.某有机物在氧气里充分燃烧,生成CO2和H2O的质量比为22:9,由此可得出的正确的结论是( )
| A. | 碳、氢、氧的原子个数比为1:2:3 | |
| B. | 碳、氢的原子个数比为1:2 | |
| C. | 该有机物中肯定不含氧元素 | |
| D. | 不能判断该有机物中是否含有氧元素 |
6.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为b%;
质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%.则
a、b、c的大小关系正确的是( )
质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%.则
a、b、c的大小关系正确的是( )
| A. | a>b>c | B. | b>a>c | C. | c>a>b | D. | c>a>b |
13.Wg镁粉和铝粉的混合物,和过量盐酸反应使金属完全溶解、在加过量的 NaOH反应,然后过滤,将沉淀完全收集后,放坩埚中灼烧,直至物质质量不再变化,取出物质称量仍为wg.求原混合物中铝粉的质量分数约为( )
| A. | 40.0% | B. | 58.6% | C. | 60.0% | D. | 47.1% |
11.下列叙述正确的是( )
| A. | 将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L NaCl溶液 | |
| B. | 将1体积c mol/L硫酸溶液用水稀释为5体积,得到0.2c mol/L硫酸溶液 | |
| C. | 将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L | |
| D. | 将w g a% NaCl溶液蒸发掉w/2 g水,得到4a% NaCl溶液 |
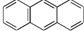 与苯炔
与苯炔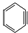 反应生成化合物X(立体对称图形),如图所示:
反应生成化合物X(立体对称图形),如图所示: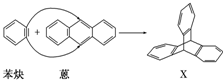
 B.
B.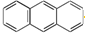 C.
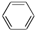
C.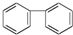 D.
D.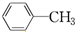
 B.C6H14 C.
B.C6H14 C.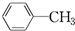 D.
D.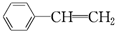
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.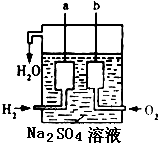 (1)氢气是一种高效而无污染的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为有效发展民用氢能源,首先必须制得廉价氢气.下列可供开发又较经济的制氢方法是C
(1)氢气是一种高效而无污染的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为有效发展民用氢能源,首先必须制得廉价氢气.下列可供开发又较经济的制氢方法是C