题目内容
10. (1)氢气是一种高效而无污染的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为有效发展民用氢能源,首先必须制得廉价氢气.下列可供开发又较经济的制氢方法是C
(1)氢气是一种高效而无污染的理想能源.1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为有效发展民用氢能源,首先必须制得廉价氢气.下列可供开发又较经济的制氢方法是CA、电解水 B、锌和稀硫酸反应 C、光解海水
(2)已知1克氢气燃烧生成液态水放出143KJ的能量,请回答下列问题:
①写出该反应的热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol.
②反应物断键需要吸收的能量<(填“>”、“<”或“=”)生成物生成新键放出的能量.
③若2mol氢气完全燃烧生成水蒸气,则放出的热量<(填“>”、“<”或“=”)2mol氢气完全燃烧生成液态水放出的能量.
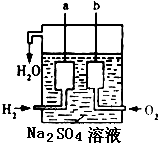
④某航天器上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成.它是将化学能转化为电能的装置.a极上的电极反应式为H2-2e-=2H+,b极上的电极反应式为O2+4e-+2H2O=4OH-.
分析 (1)根据获取途径的经济效益角度来分析;
(2)①根据反应物、生成物的状态、能量的变化写出热化学方程式;
②放热反应反应物断键需要吸收的能量<生成物生成新键放出的能量;
③根据液态水转变成气态水要吸热分析;
④氢氧燃料电池为原电池装置,将化学能转化为电能的装置,氢气为负极失电子发生氧化反应,氧气为正极得电子发生还原反应.
解答 解:(1)A、电解水需要消耗大量的电能;B、锌和稀硫酸反应应用于实验室制备少量的氢气,大量制备氢气经济效益差;C、利用太阳能使海水光解最经济,故答案为:C;
(2)①氢气、氧气、水蒸气的状态都是气态,燃烧后放出能量,所以△H<0;1g氢气的物质的量是0.5mol,则0.5mol氢气燃烧后放出143kJ的热量,所以2mol氢气燃烧后放出572 kJ的能量,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
②放热反应反应物断键需要吸收的能量<生成物生成新键放出的能量,故答案为:<;
③因为液态水转变成气态水要吸热,所以2mol氢气完全燃烧生成水蒸气,则放出的热量<2mol氢气完全燃烧生成液态水放出的能量,故答案为:<;
④氢氧燃料电池为原电池装置,将化学能转化为电能的装置,a极氢气为负极失电子发生氧化反应,反应为H2-2e-=2H+,b极氧气为正极得电子发生还原反应,反应为O2+4e-+2H2O=4OH-,故答案为:化学;电;H2-2e-=2H+;O2+4e-+2H2O=4OH-.
点评 本题考查能源与利用,反应热的计算,注意能源利用的应符合经济原则,利用化学键键能求反应热关键掌握反应物和生成物的结构,题目难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
20.下列叙述正确的是( )
| A. | 盛放浓硫酸的试剂瓶的标签上应印有警示标记 | |
| B. | 锥形瓶不可作为加热用的反应器 | |
| C. | 实验室制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| D. | 不慎将浓碱液沾到皮肤上,要立即涂上稀硫酸,再用大量水冲洗 |
1.将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如表数据:
求该反应的平衡常数值0.25.
| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
18.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
5.对A2+3B2?2AB3反应来说,以下反应速率最快的是( )
| A. | V(A2)=0.4 mol•L-1•s-1 | B. | V(B2)=0.6 mol•L-1•s-1 | ||
| C. | V(AB3)=0.5 mol•L-1•s-1 | D. | V(B2)=18 mol•L-1•min-1 |
2.KMnO4是一种重要的氧化剂.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
□MnO4-+□C2O42-+□16H+═□Mn2++□CO2↑+□8H2O.
(2)某同学为探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下
请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
(1)①在酸性条件下KMnO4的氧化性会增强.用来酸化KMnO4溶液的最佳试剂是b.
a.硝酸 b.硫酸 c.盐酸
②将MnO4-氧化C2O42-的离子方程式补充完整:
□MnO4-+□C2O42-+□16H+═□Mn2++□CO2↑+□8H2O.
(2)某同学为探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol/L.
19.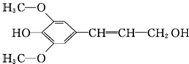 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H12O4 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面 | |
| C. | 芥子醇能与FeCl3溶液发生显色反应 | |
| D. | 1mol芥子醇能与足量溴水反应消耗3mol Br2 |
5.下列有关试纸的使用及实验现象的叙述正确的是( )
| A. | 用湿润的pH试纸测定溶液的pH,所测pH一定不准 | |
| B. | 使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| C. | 使湿润的红色石蕊试纸褪色的气体必然是SO2 | |
| D. | 用湿润的红色石蕊试纸检验NH3 |