题目内容
6.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为b%;质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%.则
a、b、c的大小关系正确的是( )
| A. | a>b>c | B. | b>a>c | C. | c>a>b | D. | c>a>b |
分析 硫酸钠的密度比水大,溶液浓度越大,密度越大,乙醇密度比水小,溶液浓度越大,密度越小;假设两种溶液的质量分数分别是x y,其中x<y,若把题中两种硫酸钠等体积混合想象成熟知的等质量混合(化陌生为熟悉),则混合后溶液中溶质的质量分数为$\frac{x+y}{2}$,硫酸钠越浓,密度越大,故等体积混合时,较浓硫酸钠的质量比混合溶液的质量一半要多,所以混合后溶液中溶质的质量分数应大于$\frac{x+y}{2}$;乙醇的密度比水小,情况和硫酸钠溶液的相反.
解答 解:假设两种溶液的质量分数分别是x y,其中x<y,
对于硫酸钠溶液,
等质量(假设都是m g)混合之后,混合溶液质量分数a%=$\frac{mx+my}{2m}$=$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的硫酸钠的密度比较小,等体积的两种硫酸钠溶液,质量分数大的质量大,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的高质量分数组分的硫酸钠,因此混合溶液质量分数b%>$\frac{x+y}{2}$;
同样,对于乙醇溶液,
等质量混合时其浓度依然是a%=$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的乙醇溶液密度比较大(因为乙醇的密度比水小),等体积的两种乙醇溶液,质量分数大的质量小,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的低质量分数组分的乙醇溶液,因此混合溶液质量分数c%<$\frac{x+y}{2}$,
则有:b>a>c,
故选B.
点评 本题考查了溶质质量分数的计算与判断,题目难度中等,注意掌握溶质质量分数为概念及表达式,明确硫酸钠的浓度越大、密度越大,乙醇的浓度越大、密度越小为解答关键.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
16. 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 1:3 |
17.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 二氯甲烷的分子数约为NA 个 | |
| B. | 常温常压下,2.0 g 重水(D2O)中含NA 个中子 | |
| C. | 1 L 0.1mol•L-1 的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA 个,则阳极质量减少64 g |
14.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液于稀硫酸反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH -═Cl-+ClO-+H2O | |
| D. | 实验室中氯气的制取:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O |
1.将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如表数据:
求该反应的平衡常数值0.25.
| 温度/℃ | 起始浓度 | 平衡浓度 | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
11.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
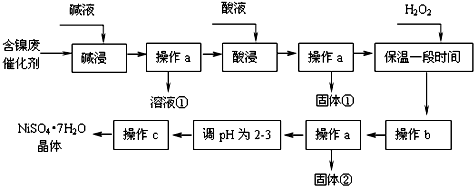
部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
18.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20 mol PCl3 和0.20molCl2,反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3 和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
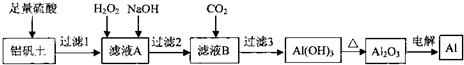
1.某学习小组模拟工业上由铝矾土(含Al203和少量的Si02及铁的氧化物)制备 金属铝的方法,设计了实验室用铝矾土制备金属铝的方案,主要流程如图所示:
已知:
(1)为了加快铝矾土的酸溶速率,除了反应过程不断搅拌外,还可釆取的措施有升高反应温度,增大硫酸浓度,粉碎铝土矿等(至少二条).
(2)加入H202时,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.要检验Fe2+是否反应完全应选择的试剂是KMnO4.(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液).加入NaOH调节滤液A的pH在10.8--14范围.
(3)流程中有多次过滤,需制作一个简单的过滤器,所需的用品有漏斗,滤纸
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO.相关反应的热化学 方程式如下:
C(s,石墨)+02(g)=C02(g)△H=-393.5kJ•mol-1
2C(s,石墨)+02(g)=2C0(g)△T=-221.0kJ•mol-1
若C02和CO的体积比为1:1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量141.5 kJ.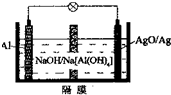
(5)新型铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池正极反应式为AgO+H2O+2e-=Ag+2OH-.

已知:
| 氢氧化物 | 开始沉淀pH | 沉淀完全pH | 开始溶解pH | 溶解完全pH |
| Fe(OH)3 | 2.3 | 4.1 | 14 | - |
| Al(OH)3 | 2.3 | 5.2 | 7.8 | 10.8 |
(2)加入H202时,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.要检验Fe2+是否反应完全应选择的试剂是KMnO4.(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液).加入NaOH调节滤液A的pH在10.8--14范围.
(3)流程中有多次过滤,需制作一个简单的过滤器,所需的用品有漏斗,滤纸
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO.相关反应的热化学 方程式如下:
C(s,石墨)+02(g)=C02(g)△H=-393.5kJ•mol-1
2C(s,石墨)+02(g)=2C0(g)△T=-221.0kJ•mol-1
若C02和CO的体积比为1:1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量141.5 kJ.

(5)新型铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池正极反应式为AgO+H2O+2e-=Ag+2OH-.