题目内容
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
已知:2NO2+2NaOH→NaNO3+NaNO2+H2O
NO+NO2+2NaOH→2NaNO2+H2O
(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为mol/L,需要质量分数为w%,密度为ρg/cm3的浓硝酸mL(均用最简分式表示).
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少L才能使生成的气体吸收完全(均用最简分式表示).
(3)丙组取某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).列式计算原混合酸中硝酸的物质的量是多少?硫酸的物质的量浓度多少?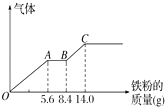
【答案】
(1)![]() ;
;![]()
(2)![]() ;
;![]()
(3)解:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.
OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,OA段消耗Fe为5.6g,所以n(NO3﹣)=n(Fe)= ![]() =0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;
=0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;
最终消耗Fe为14g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe)= ![]() =0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)=
=0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)= ![]() =2.5mol/L,
=2.5mol/L,
答:原混合酸中硝酸的物质的量是0.2mol,硫酸的浓度为2.5mol/L.
【解析】解:(1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2× ![]() =
= ![]() mol,则硝酸浓度为
mol,则硝酸浓度为 ![]() =
= ![]() mol/L;根据c=
mol/L;根据c= ![]() 可知,浓硝酸的物质的量浓度为
可知,浓硝酸的物质的量浓度为 ![]() mol/L=
mol/L= ![]() mol/L,需要浓硝酸的体积为
mol/L,需要浓硝酸的体积为  =
= ![]() L=
L= ![]() mL,所以答案是:
mL,所以答案是: ![]() ;
; ![]() ;(2)设溶液质量增重为m,则:
;(2)设溶液质量增重为m,则:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 溶液质量增重
192 192﹣60=132
bg m
所以m= ![]() g=
g= ![]() g,
g,
Cu的物质的量为 ![]() =
= ![]() mol,根据电子转移守恒,生成NO物质的量为
mol,根据电子转移守恒,生成NO物质的量为 ![]() =
= ![]() mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为
mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为 ![]() mol×
mol× ![]() =
= ![]() mol,由2NO+O2=2NO2可知,需要通入氧气为
mol,由2NO+O2=2NO2可知,需要通入氧气为 ![]() mol×
mol× ![]() ×22.4L/mol=
×22.4L/mol= ![]() L,
L,
所以答案是: ![]() ;
; ![]() ;
;

 阅读快车系列答案
阅读快车系列答案