题目内容
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
FeO+CO→Fe+CO2
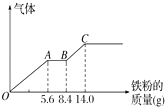
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.则此固体成分和它们的物质的量之比可能的是( )
A.n(FeO):n(Fe3O4)=1:1
B.n(Fe2O3):n(FeO)=2:1
C.n(Fe2O3):n(FeO)=1:2
D.n(Fe2O3):n(Fe3O4)=1:1
【答案】AC
【解析】解:固体质量减少为CO获得的氧原子质量,根据固体质量差,可知减少O原子质量为4.8g﹣4.56g=0.24g,减少O原子物质的量为 ![]() =0.015mol,氧化铁的物质的量为
=0.015mol,氧化铁的物质的量为 ![]() =0.03mol,则反应后氧化物中O原子物质的量为0.03moL×3﹣0.015mol=0.075mol,反应中Fe原子物质的量不变,则反应后氧化物中Fe、O原子数目之比为0.03mol×2:0.075mol=4:5.
=0.03mol,则反应后氧化物中O原子物质的量为0.03moL×3﹣0.015mol=0.075mol,反应中Fe原子物质的量不变,则反应后氧化物中Fe、O原子数目之比为0.03mol×2:0.075mol=4:5.
A.当n(FeO):n(Fe3O4)=1:1,则Fe、O原子数目之比为(1+3):(1+4)=4:5,故A正确;
B.当n(Fe2O3):n(FeO)=2:1,则Fe、O原子数目之比为(2+1):(3+1)=3:4,故B错误;
C.当n(Fe2O3):n(FeO)=1:2,则Fe、O原子数目之比为(2+1×2):(3+1×2)=4:5,故C正确;
D.当n(Fe2O3):n(Fe3O4)=1:1,则Fe、O原子数目之比为(2+3):(3+4)=5:7,故D错误,
故选:AC.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是酸的酸酐,Cl2O电子式为 .
(2)下列能判断Cl和O两种元素非金属性强弱的是(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,其离子方程式是 , 氧化产物 . (填离子符号)
(5)一定条件下,在水溶液中1mol Cl﹣、ClO ![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示).
(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示). 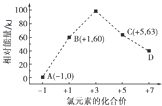
【题目】国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2 852 | 714 |
A. 宇航员喝茶时注入的H2O的摩尔质量是18克
B. H2O+Cl2![]() HCl+HClO这反应属于氧化还原反应
HCl+HClO这反应属于氧化还原反应
C. 氢的三种同位素1H、2D、3T与16O只能形成三种水分子
D. 在标准状况下,1mol水的体积约是22.4L