题目内容
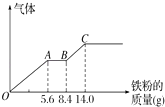
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: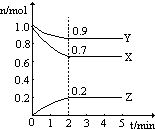
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;平衡时,X的转化率为 30% ;平衡时,Y的浓度为;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号);
A.容器内压强不再发生变化
B.X的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol的Z的同时消耗n mol的Y
E.相同时间内消耗n mol的Y的同时消耗3n mol的X.
【答案】
(1)3X+Y?2Z
(2)0.05mol?L﹣1?min﹣1;30%;0.45mol/L
(3)ABD
【解析】解:(1)△n(X)=1.0mol﹣0.7mol=0.3mol;△n(Y)=1.0mol﹣0.9mol=0.1mol;△n(Z)=0.2mol,三者计量数之比为3:1:2,所以该反应的化学方程式为3X+Y2Z,所以答案是:3X+Y2Z;(2)v(Z)= ![]() =
= ![]() =0.05molL﹣1min﹣1; X转化的物质的量为1.0mol﹣0.7mol=0.3mol,转化率为
=0.05molL﹣1min﹣1; X转化的物质的量为1.0mol﹣0.7mol=0.3mol,转化率为 ![]() =30%;
=30%;
Y的浓度C= ![]() =
= ![]() =0.45mol/L;所以答案是:0.05molL﹣1min﹣1;30%;0.45mol/L;(3)A.反应3X+Y2Z是一个反应前后气体体积变化的反应,容器内压强不再发生变化,说明达到平衡状态,故A正确;B.X的体积分数不再发生变化,说明X的量不在变化,达到平衡状态,故B正确;C.化学反应不改变原子数目,化学平衡与容器内气体原子总数无关,故C错误;D.相同时间内消耗2n mol的Z的同时会生成n mol的Y,而同时消耗n mol的Y,说明Y的正逆反应速率相等,达到平衡状态,故D正确;
=0.45mol/L;所以答案是:0.05molL﹣1min﹣1;30%;0.45mol/L;(3)A.反应3X+Y2Z是一个反应前后气体体积变化的反应,容器内压强不再发生变化,说明达到平衡状态,故A正确;B.X的体积分数不再发生变化,说明X的量不在变化,达到平衡状态,故B正确;C.化学反应不改变原子数目,化学平衡与容器内气体原子总数无关,故C错误;D.相同时间内消耗2n mol的Z的同时会生成n mol的Y,而同时消耗n mol的Y,说明Y的正逆反应速率相等,达到平衡状态,故D正确;
E.相同时间内消耗n mol的Y的同时必定消耗3n mol的X,和化学平衡状态无关,故E错误.所以答案是:ABD.
【考点精析】通过灵活运用化学平衡状态的判断,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等即可以解答此题.

【题目】已知甲和乙的某些性质如下表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A. 蒸发B. 过滤C. 蒸馏D. 萃取