题目内容
【题目】将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是

A. KNO3盐桥中的K+移向CuSO4溶液
B. Ag作负极,Cu作正极
C. 工作一段时间后,CuSO4溶液中c(Cu2+)增大
D. 取出盐桥后,电流计的指针依然发生偏转
【答案】C
【解析】
该原电池中Cu为负极,Cu极的电极反应式为Cu-2e-=Cu2+,Ag为正极,Ag极的电极反应式为Ag++e-=Ag,由原电池的工作原理分析可得结论。
A.KNO3盐桥中的K+移向正极,移向AgNO3溶液,故A错误;
B.由上述分析可知Cu为负极,Ag为正极,故B错误;
C.负极反应生成的Cu2+进入CuSO4溶液中,工作一段时间后,CuSO4溶液中c(Cu2+)增大,故C正确;
D.取出盐桥后,不能形成闭合回路,电流表的指针不会发生偏转,故D错误;
答案选C。

【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
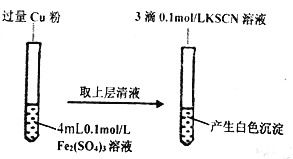
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
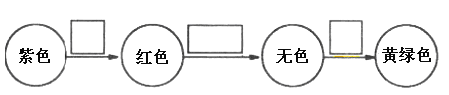
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
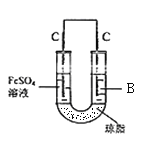
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。