��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ�-���ڱ��е�λ�ã��ش��������⣺

��1���������ڰ뵼����ϵ�Ԫ�������ڱ��е�λ��________________________��
��2��д�������ڽ�������ǿ��Ԫ�ص����ӽṹʾ��ͼ:_____��
��3���ۡ��ܡ�����Ԫ�����Ӱ뾶�Ӵ�С��˳����________________�����ӷ��ţ���
��4���ڡ��ۡ��ܵ���̬�⻯��ȶ�����ǿ����_______________�ѧʽ����
��5�����ʵ��֤���ݡ��Ľ�����ǿ��__________________________��
��6����һ�������£������û���Ӧ��ʵ������֮���ת���������ڢ�-�����漰��Ԫ�أ�
��ͬ��Ԫ��֮�䣬��Ӧ����Ϊ_____________��
�ڲ�ͬ��Ԫ��֮�䣬��Ӧ����Ϊ_____________�����Ϸ�Ӧ��дһ����ѧ����ʽ���ɣ���
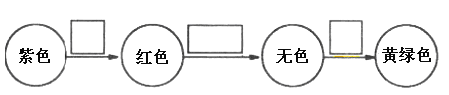
��7������ĵ���ͨ��ʯ����Һ�з�������ɫ�仯����ͼ�����ڷ�������д�����¸ý���ɫ�仯����Ҫ���ӷ�����_____________��_____________��_____________��
���𰸡���3����IVA�� 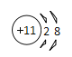 O2-��F-��Na+ HF ���ƺ�þ�ֱ�����ˮ��Ӧ���Ʊ�þ��Ӧ���ң��������Ʊ�þǿ 2Na+2H2O=2NaOH+H2����2C+SiO2
O2-��F-��Na+ HF ���ƺ�þ�ֱ�����ˮ��Ӧ���Ʊ�þ��Ӧ���ң��������Ʊ�þǿ 2Na+2H2O=2NaOH+H2����2C+SiO2 ![]() Si+2CO����O2+2H2S=2S+2H2O�� Mg+2HCl=MgCl2+H2����2Mg+CO2
Si+2CO����O2+2H2S=2S+2H2O�� Mg+2HCl=MgCl2+H2����2Mg+CO2 ![]() 2MgO+C��Cl2+H2S=2S+2HCl�� H+ HClO Cl2
2MgO+C��Cl2+H2S=2S+2HCl�� H+ HClO Cl2
��������
���ݸ�Ԫ�������ڱ��е����λ�ÿ�֪����ΪHԪ�ء���ΪCԪ�ء���ΪOԪ�ء���ΪFԪ�ء���ΪNaԪ�ء���ΪMgԪ�ء���ΪSiԪ�ء���ΪSԪ�ء���ΪClԪ��
��1�����ڰ뵼����ϵ�Ԫ��ΪSi��λ�ڵ�3���ڢ�A�壻
��2�������ڽ�������ǿ��Ԫ��ΪNa�������ӵ����ӽṹʾ��ͼΪ��![]() ��
��
��3��������ͬ���Ӳ�ṹ�����������Ӱ뾶����ԭ���������������С�����Ԣۡ��ܡ�����Ԫ�ص����Ӱ뾶�ɴ�С˳��Ϊ��O2-��F-��Na+��
��4���ǽ�����Խǿ����̬�⻯���ȶ���Խǿ��C��O��F�зǽ�������ǿ��ΪF�����⻯���ȶ�����ǿ��ΪHF��
��5����ΪNaԪ�ء���ΪMgԪ�أ�������Na��Mg��֤������Ϊ�����ƺ�þ�ֱ�����ˮ��Ӧ���Ʊ�Mg��Ӧ���ң������Ա�Mgǿ��
��6����ͬ��Ԫ��֮�䣬�������û���Ӧ��ʵ������֮���ת�����磺2Na+H2O��2NaOH+H2����
�ڲ�ͬ��Ԫ��֮�䣬�������û���Ӧ��ʵ������֮���ת�����磺Mg+2HCl��MgCl2+H2����
��7����ΪClԪ�أ��䵥��Ϊ������������ͨ��ʯ����Һ�з�Ӧ����HCl��HClO����Һ�����ԣ�H+ʹ��Һ��Ϊ��ɫ��HClO����Ư���ԣ���ʹ��Һ��ɫ��ȥ����Һ�������ܽ�������ʹ��Һ�ʻ���ɫ��