题目内容
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)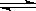 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) =" c(CO)=" c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
 此时上述的反应中正、逆反应速率的关系式是 (填代号)。
此时上述的反应中正、逆反应速率的关系式是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
CO2(g) + H2(g)
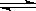 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) =" c(CO)=" c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
 此时上述的反应中正、逆反应速率的关系式是 (填代号)。
此时上述的反应中正、逆反应速率的关系式是 (填代号)。a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(7分)(1)  (2分)(2)放热;(1分)
(2分)(2)放热;(1分)
(3)B、D;(选对一个得一分,选错一个不得分)(2分) (4)b (2分)
 (2分)(2)放热;(1分)
(2分)(2)放热;(1分)(3)B、D;(选对一个得一分,选错一个不得分)(2分) (4)b (2分)
试题分析:(1)由于平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以根据反应的化学方程式可知,平衡常数K=
 。
。(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数减小,说明化学平衡逆向移动,因此正反应方向放热反应。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据反应CO2(g)+H2(g)
 CO(g)+H2O(g)可知,反应是前后气体体积不变的反应,正向是放热反应,所以能判断该反应是否已经达到化学平衡状态的是:A中反应是前后气体体积不变的反应,反应过程中压强不变,不能判断是否平衡,故A不符合;B中混合气体中CO浓度不变,说明反应达到平衡,故B符合;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确;D中如果c(CO2) =" c(CO)=" c(H2) = c(H2O),则此时K
CO(g)+H2O(g)可知,反应是前后气体体积不变的反应,正向是放热反应,所以能判断该反应是否已经达到化学平衡状态的是:A中反应是前后气体体积不变的反应,反应过程中压强不变,不能判断是否平衡,故A不符合;B中混合气体中CO浓度不变,说明反应达到平衡,故B符合;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确;D中如果c(CO2) =" c(CO)=" c(H2) = c(H2O),则此时K=1,所以根据表中的数据可知,反应已经达到平衡状态,则答案选BD。
(4)根据表中数据可知,此时K=
 >1.0。所以反应没有达到平衡状态,此时反应应该是向逆反应方向进行的,所以v(正)<v(逆),答案选b。
>1.0。所以反应没有达到平衡状态,此时反应应该是向逆反应方向进行的,所以v(正)<v(逆),答案选b。点评:该题是中等难度的试题,试题贴近高考,综合性强,试题基础性强,侧重能力的培养和解题方法的指导,主要是考查学生分析和解决问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。

练习册系列答案
相关题目
 CO(g)+H2O(g)
CO(g)+H2O(g) 2NH3(g)
2NH3(g) 2Z 反应影响的示意图图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。
2Z 反应影响的示意图图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。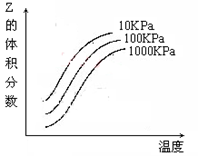

 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0  2NH3(g) ΔH<0
2NH3(g) ΔH<0 3C(g)。
3C(g)。 4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是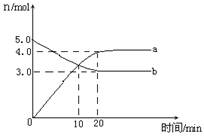
 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是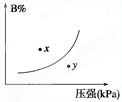
 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。