题目内容
19.把11.7g NaCl固体放人500ml的烧杯中,加入150ml蒸馏水搅拌至完全溶解,然后将溶液全部转移到容器M中,再用蒸馏水稀释至完全充满;从中取出溶液100ml,该溶液恰好与50mL 0.40mol•L-lAgN03溶液完全反应.则M的体积为( )| A. | 100 ml. | B. | 250 ml. | C. | 500 ml. | D. | 1 L. |
分析 n(NaCl)=$\frac{11.7g}{58.5g/mol}$=0.2mol,NaCl和AgN03反应方程式为NaCl+AgN03=AgCl↓+NaN03,根据方程式知,二者反应时氯化钠和硝酸银物质的量相等,所以100mL溶液中c(NaCl)=$\frac{0.40mol/L×0.05L}{0.1L}$=0.20mol/L,同一溶液物质的量浓度相等,所以M的体积=$\frac{n(NaCl)}{c(NaCl)}$.
解答 解:n(NaCl)=$\frac{11.7g}{58.5g/mol}$=0.2mol,NaCl和AgN03反应方程式为NaCl+AgN03=AgCl↓+NaN03,根据方程式知,二者反应时氯化钠和硝酸银物质的量相等,所以100mL溶液中c(NaCl)=$\frac{0.40mol/L×0.05L}{0.1L}$=0.20mol/L,同一溶液物质的量浓度相等,所以M的体积=$\frac{n(NaCl)}{c(NaCl)}$=$\frac{0.2mol}{0.20mol/L}$=1L,
故选D.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意溶液均一性原则,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.现有常温下的四份溶液:①0.01mol/L 醋酸溶液;②0.01mol/L盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④混合,若有c(CH3COO-)>c(H+),则c(OH-)>c(Na+) | |
| D. | 将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
14.下列实验操作中不正确的是( )
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
4.对于碳酸溶液中的电离平衡,电离常数的表达式中正确的是( )
| A. | K=$\frac{c(C{O}_{3}^{2-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | B. | K=$\frac{c(C{O}_{3}^{2-}){c}^{2}({H}^{+})}{c({H}_{2}C{O}_{3})}$ | ||
| C. | K1=$\frac{c(HC{O}_{3}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | D. | K2=$\frac{(C{O}_{3}^{2-})c({H}^{+})}{c(HC{O}_{3}^{-})}$ |
9.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H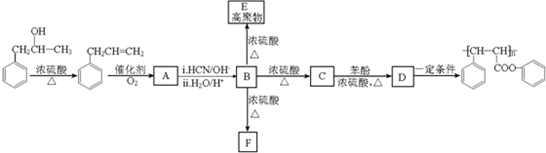

 .
.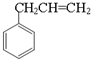 生成A的化学方程式为
生成A的化学方程式为 +HCHO.
+HCHO.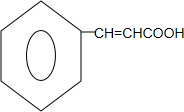 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$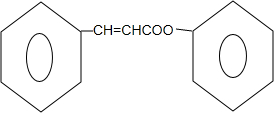 +H2O.
+H2O. (任写一种结构简式).
(任写一种结构简式). 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.