题目内容
7.高聚酚酯是涂料行业中的新成员,其环保功能越来越受到人们的青睐.下图是某种高聚酚酯的合成路线图: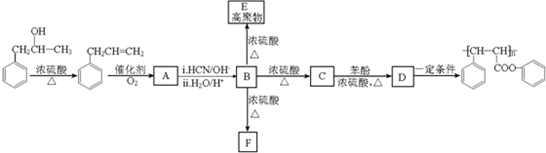
已知:①CH3CH═CH2$→_{O_{2}}^{催化剂}$CH3CHO+HCHO;
②RCHO$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$

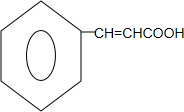
③F为含有三个六元环的酯.
请回答下列问题:
(1)A的化学名称为苯乙醛,B→F的反应类型是取代反应(或酯化反应).
(2)F的分子式为C18H16O4,E的结构简式为
 .
.(3)由
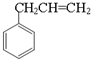 生成A的化学方程式为
生成A的化学方程式为 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO.
+HCHO.(4)C转化为D的化学方程式是
 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$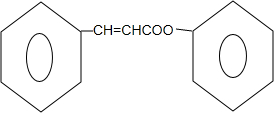 +H2O.
+H2O.(5)B的同分异构体中,含有苯环、且苯环上有两个取代基、一个取代基中含有酯基、另一个取代基上含有醇羟基的有15种,其中核磁共振氢谱为5组峰,且峰面积之比为3:2:2:2:1的为
 (任写一种结构简式).
(任写一种结构简式).
分析 据已知反应①和F为含有三个六元环的酯可知,A为苯乙醛 ,据已知反应②可知B为
,据已知反应②可知B为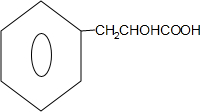 ,B在浓硫酸作用下发生分子间的酯化反应生成F,B在浓硫酸作用下发生缩聚反应生成的高聚物E为
,B在浓硫酸作用下发生分子间的酯化反应生成F,B在浓硫酸作用下发生缩聚反应生成的高聚物E为 ,B在浓硫酸作用下发生消去反应生成的C为
,B在浓硫酸作用下发生消去反应生成的C为 ,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为
,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为 ,据此分析.
,据此分析.
解答 解:据已知反应①和F为含有三个六元环的酯可知,A为苯乙醛 ,据已知反应②可知B为
,据已知反应②可知B为 ,B在浓硫酸作用下发生分子间的酯化反应生成F,B在浓硫酸作用下发生缩聚反应生成的高聚物E为
,B在浓硫酸作用下发生分子间的酯化反应生成F,B在浓硫酸作用下发生缩聚反应生成的高聚物E为 ,B在浓硫酸作用下发生消去反应生成的C为
,B在浓硫酸作用下发生消去反应生成的C为 ,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为
,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为 ,
,
(1)据已知反应①和F为含有三个六元环的酯可知,A为苯乙醛 ,据已知反应②可知B为
,据已知反应②可知B为 ,B在浓硫酸作用下发生分子间的酯化反应生成F,故答案为:苯乙醛;取代反应(或酯化反应);
,B在浓硫酸作用下发生分子间的酯化反应生成F,故答案为:苯乙醛;取代反应(或酯化反应);
(2)B在浓硫酸作用下发生分子间的酯化反应生成F,F为含有三个六元环的酯,分子式为C18H16O4,B在浓硫酸作用下发生缩聚反应生成的高聚物E为 ,故答案为:C18H16O4;
,故答案为:C18H16O4; ;
;
(3)据已知反应①,由 生成
生成 的化学方程式为
的化学方程式为 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO,
+HCHO,
故答案为: +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO;
+HCHO;
(4)C为 ,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为
,据D发生加聚反应的产物判断,C与苯酚发生酯化反应生成的D为 ,反应的化学方程式为
,反应的化学方程式为 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;
+H2O;
(5)B为 ,B的同分异构体中,含有苯环、且苯环上有两个取代基、一个取代基中含有酯基、另一个取代基上含有醇羟基的有-OOCH和-CH2CH2OH,临间对3种,或-OOCH和-CHOHCH3,临间对3种,或-COOCH3和-CH2OH,临间对3种,或-OOCCH3和-CH2OH,临间对3种,或-CH2OOCH和-CH2OH,临间对3种,共15种,其中核磁共振氢谱为5组峰,且峰面积之比为3:2:2:2:1的为
,B的同分异构体中,含有苯环、且苯环上有两个取代基、一个取代基中含有酯基、另一个取代基上含有醇羟基的有-OOCH和-CH2CH2OH,临间对3种,或-OOCH和-CHOHCH3,临间对3种,或-COOCH3和-CH2OH,临间对3种,或-OOCCH3和-CH2OH,临间对3种,或-CH2OOCH和-CH2OH,临间对3种,共15种,其中核磁共振氢谱为5组峰,且峰面积之比为3:2:2:2:1的为 ,故答案为:15;
,故答案为:15; .
.
点评 本题易以有机物的推断与合成考查有机物的结构与性质,难度中等,充分利用有机物的结构、反应条件及反应信息进行判断,掌握官能团的性质与理解反应信息是关键,能较好的考查考生的自学能力和知识迁移应用能力,是热点题型.

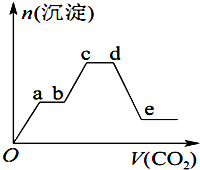 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段与cd段所消耗CO2的体积相同 | |
| C. | bc段反应的离子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀减少是由于BaCO3固体的消失 |
| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
| A. | 100 ml. | B. | 250 ml. | C. | 500 ml. | D. | 1 L. |
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
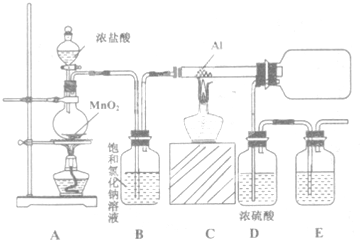
| 实验序号 | 温度 /℃ | H2O2溶液 初始浓度/% | MnO2 颗粒大小 |
| 1 | 25 | 4 | 无MnO2 |
| 2 | 25 | 12 | 1g细颗粒MnO2 |
| 3 | 25 | 4 | 1g细颗粒MnO2 |
| 4 | 25 | 4 | 1g粗颗粒MnO2 |
(2)实验3、4预期可得出的结论是催化剂颗粒越小,化学反应速率越大.
(3)设计实验2、3的目的是探究浓度对化学反应速率的影响.
(4)设计一个实验证明在其他条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤):取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.