题目内容
11. 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.(1)如果开启a和c,关闭b,则Ⅰ中反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)如果将Ⅰ管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会儿观察,可以看到Ⅱ里浸入水中的导管口有气泡冒出,导管内气体呈红棕色,液面上方气体为无色,试解释这一现象Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O、3NO2+H2O═2HNO3+NO.(用化学方程式表示)
(3)在问题(1)的实验中,要使Ⅱ里的气体始终保持无色,应该怎样操作?先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应.
(4)现给你一试管NO2,其他药品和仪器自选,请你设计实验,要求尽可能多地使NO2被水吸收,在虚线框中画出你设计的装置图.

分析 (1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;
(3)始终保持无色,装置Ⅱ中不能含有空气,需要Ⅲ反应生成二氧化碳把装置Ⅱ中的空气赶净,生成的二氧化氮与水反应生成无色气体;
(4)实验过程中先将试管倒扣在水槽中,待到气体变为无色后通入氧气,直至试管中充满液面为止,据此写出装置图.
解答 解:(1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水,反应的化学方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,反应的方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,二氧化氮和水反应生成一氧化氮,导管内气体呈红棕色,液面上气体是无色,反应方程式为:3NO2+H2O═2HNO3+NO,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O、3NO2+H2O═2HNO3+NO;
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应,
故答案为:先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应;
(4)实验过程中试管倒扣在水槽中,二氧化氮是红棕色气体,溶于水反应生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO,进入试管中液体体积占试管容积的三分之二,剩余气体变化为无色;液面不再上升时通入氧气与一氧化氮反应生成红棕色二氧化氮,二氧化氮溶于水又生成一氧化氮和硝酸,气体变化为无色气体,液面上升,直至当试管充满液体无气体剩余,据此画出装置图为: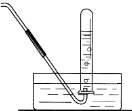 ,
,
故答案为: .
.
点评 本题考查了实验装置的综合应用,题目难度中等,明确发生反应的原理为解答关键,注意掌握常见实验装置的特点及使用方法,试题培养了学生的分析能力及化学实验能力.

| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
| A. | 100 ml. | B. | 250 ml. | C. | 500 ml. | D. | 1 L. |
| A. | 将PH=a的NaOH溶液加水稀释至10n倍,则溶液的PH变为a-n | |
| B. | 等浓度的氨水和NH4Cl溶液等体积混合后:c(NH${\;}_{4}^{+}$)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 向NaOH溶液中逐滴加入CH3COOH溶液至PH=7,水的电离程度逐渐增大 | |
| D. | PH=5.6的NaHSO3溶液:c(Na+)>c(HSO${\;}_{3}^{_}$)>c(H2SO3)>c(SO${\;}_{3}^{2-}$) |
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
| A. | 前者大于后者 | B. | 前者小于后者 | C. | 前者等于后者 | D. | 无法确定 |