题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g) ![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
【答案】 0.025 mol·L-1·min-1 0.05 mol·L-1·min-1 -41.8 b、d
【解析】(1)对于反应:2SO2(g)+O2(g) ![]() 2SO3(g);反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
2SO3(g);反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=![]() υ(SO2)=0.05 mol·L-1·min-1×
υ(SO2)=0.05 mol·L-1·min-1×![]() =0.025 mol·L-1·min-1;υ(SO3)= υ(SO2)=0.05 mol·L-1·min-1,故答案为:0.025 mol·L-1·min-1;0.05 mol·L-1·min-1;
=0.025 mol·L-1·min-1;υ(SO3)= υ(SO2)=0.05 mol·L-1·min-1,故答案为:0.025 mol·L-1·min-1;0.05 mol·L-1·min-1;
(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,利用盖斯定律将①×![]() -②×
-②×![]() 得NO2(g)+SO2(g)SO3(g)+NO(g)△H=
得NO2(g)+SO2(g)SO3(g)+NO(g)△H=![]() ×(-196.6kJmol-1)-
×(-196.6kJmol-1)- ![]() ×(-113.0kJmol-1)=-41.8kJmol-1,故答案为:-41.8;
×(-113.0kJmol-1)=-41.8kJmol-1,故答案为:-41.8;
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;d.物质的量之比等于化学计量数之比,每消耗1mol SO3的同时生成1molNO,表示正逆反应速率相等,反应达到平衡状态,故d正确;故答案为:bd。

【题目】氯酸钾是一种强氧化剂,在不同条件下KClO3将KI氧化为I2或KIO3。某实验小组在实验室中对KClO3和KI的反应进行了探究。回答下列问题:
实验一 制取氯酸钾
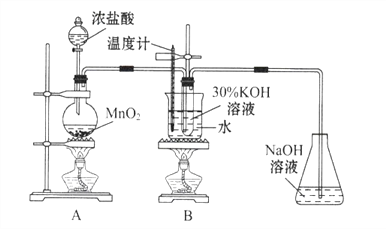
(1)A中反应的化学方程式为_______。实验开始时,首先进行的实验步骤是________。
(2)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有_______.
(3)A和B装置之间缺少除去氯气中氯化氢的装置,是否会对实验结果产生不利影响,其理由是_________(填“是”或“否”,若选择“是”请说明理由,若选择“否”则不需说明理由)
实验二 氯酸钾与碘化钾反应的研究
(4)该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__.
②设计1号试管实验的作用是__.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl