��Ŀ����
����Ŀ���������һ��ǿ���������ڲ�ͬ������KClO3��KI����ΪI2��KIO3��ijʵ��С����ʵ�����ж�KClO3��KI�ķ�Ӧ������̽�����ش��������⣺
ʵ��һ����ȡ�����
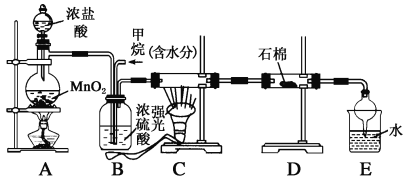
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ_______��ʵ�鿪ʼʱ�����Ƚ��е�ʵ�鲽����________��
��2����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˣ�ϴ�ӣ���ʵ�����������Ҫ�IJ���������_______��
��3��A��Bװ��֮��ȱ�ٳ�ȥ�������Ȼ����װ�ã��Ƿ���ʵ������������Ӱ�죬��������_________����������������������ѡ����������˵�����ɣ���ѡ������������˵�����ɣ�
ʵ������������⻯�ط�Ӧ���о�
��4����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ�����Ӱ�죬����ϵ��aʵ��ļ�¼�����£�ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0.20molL��1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3��s��/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL��1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����__��
�����1���Թ�ʵ���������__��
����2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ���������Һ����ɫ��������������Ψһ����ԭ����ΪKCl
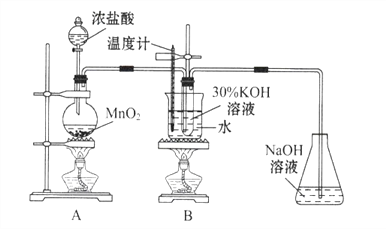
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2+H2O���װ���������ձ���©��������������ͷ�ιܣ����ͷ�ιܲ��۷֣��������л�����Ȼ������KOH��Ӧ����������صIJ����о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ������Ũ��Ϊ0�Ķ���ʵ��ClO3-+6I-+6H+= Cl-+3I2+3H2O
MnCl2+Cl2+H2O���װ���������ձ���©��������������ͷ�ιܣ����ͷ�ιܲ��۷֣��������л�����Ȼ������KOH��Ӧ����������صIJ����о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ������Ũ��Ϊ0�Ķ���ʵ��ClO3-+6I-+6H+= Cl-+3I2+3H2O
�����������⿼�鳣�����ʵ�ʵ������ȡ������������ʵļ��鼰��ͬ��Ӧ�����Բ����Ӱ����й�֪ʶ�㣬�������Ʊ���ԭ����ʵ��װ�á��������ռ����Ͳ�ͬ�ķ�Ӧ�������֣��������ʵ����ʡ���Һ������Լ��й�ʵ��������н��
��1��A����ȡCl2����ӦΪ MnO2+4HCl��Ũ��![]() MnCl2+Cl2+H2O ���й��������ȡʵ�飬�����ȼ��װ�õ������ԣ��𰸣����ȼ��װ�õ������ԡ�
MnCl2+Cl2+H2O ���й��������ȡʵ�飬�����ȼ��װ�õ������ԣ��𰸣����ȼ��װ�õ������ԡ�
��2�����ˣ�ϴ�Ӿ��壬��Ҫ�õ����������ձ���©����ϴ�ӵ�ʱ������ʹ�ý�ͷ�ιܣ���Ϊ�����������ձ���©������ͷ�ι�
��3���ӷ�����HCl����KOH��Ӧ����Cl2��Ӧ��KOH���٣�KClO3�������١��𰸣������Ӱ�죬ԭ�����Ȼ������KOH��Ӧ����������صIJ��� ��
��4���������ϱ��п�֪��4�������У�KClO3���������䣬KI�����ʵ������䣬��Һ����������䣬KI��Ũ�Ȳ��䣬����ĵ�����Ǹı�ģ���Ϻ������Ũ���DZ仯�ģ�Ψһ�ı��������ʵ���Ŀ���ǣ��о���Ӧ��ϵ������Ũ�ȶԷ�Ӧ�����Ӱ�� ��
��1���Թ���δ�����ᣬ������֧�Թܾ������ᣬĿ����̽�������Ƿ�Բ�����Ӱ�������һ���Ա�ʵ�飬��Ϊ�� ����Ũ��Ϊ0�Ķ���ʵ�顣
����Һ��Ϊ��ɫ�����������Һ����ɫ��֤��������I2���ʣ����ӷ���ʽΪClO3-+6I-+6H+= Cl-+3I2+3H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�