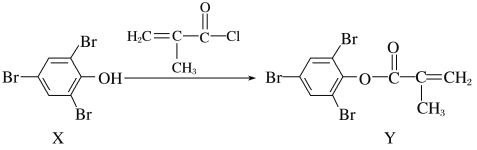
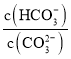题目内容
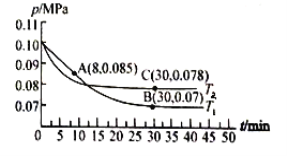
【题目】已知 pOH=-lgc(OH-)。向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )

A.稀H2SO4 的物质的量浓度为0.05mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在[NH3·H2O]+2[OH-]=[NH4+]+2[H+]
D.a、b、c 三点对应 NH4+的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
【答案】B
【解析】
向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应,放热最多,溶液的温度最高,所以硫酸的体积为20mL时,恰好完全反应。
A.20mL0.1mol·L-1 的氨水中含有一水合氨的物质的量为0.1 mol·L-1×0.02L=0.002mol,硫酸的体积为20mL时,恰好完全反应,则消耗硫酸的物质的量为0.001mol,该硫酸的物质的量为0.001 mol /0.02L=0.05mol/L,故正确;
B.当溶液中的pH=pOH时,溶液为中性,此时溶质为硫酸铵和氨水,铵根离子的水解程度与氨水的电离程度相等,水的电离几乎没有影响,当氨水与硫酸恰好反应生成硫酸铵时,即b点时,铵根离子水解,促进了水的电离,此时水的电离程度最大,故错误;
C.a点加入10mL等浓度的氨水,反应后溶质为一水合氨和硫酸铵,且一水合氨为硫酸铵浓度的2倍,根据电荷守恒可得:[NH4+] +[H+]= 2[SO42-]+[OH-],根据物料守恒可得:[NH3·H2O]+ [NH4+]= 4[SO42-],二者结合可得:[NH3·H2O]+2[OH-]=[NH4+]+2[H+],故正确;
D.升高温度促进氨水的电离,电离常数增大,由图可知,温度:b>a>c,则a、b、c三点氨水的电离常数Kh(b)>Kh(a)>Kh(c),故正确。
故选B。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
① |
| 稀盐酸 | 偏向 |
② |
| 稀盐酸 | 偏向 |
③ |
| 稀盐酸 | 偏向石墨 |
④ |
| 氢氧化钠溶液 | 偏向 |
⑤ |
| 浓硝酸 | 偏向 |
试根据表中的电流表指针偏转方向回答下列问题:
(1)实验1、2中![]() 所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
(2)由实验3完成下列填空:
①铝为________极,电极反应式为________________;
②石墨为________极,电极反应式为________________;
③电池总反应为________。
(3)实验4中铝作负极还是正极?________,理由是_______。写出铝电极的电极反应式:_______。
(4)解释实验5中电流表指针偏向铝的原因:_________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________。