题目内容
【题目】CO2 可用于合成多种化工原料。用 CO2 生产绿色燃料甲醇时发生反应A: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
(1)反应 A 的平衡常数表达式是_____。在恒温恒容的密闭容器中进行该反应,下列说法正确的是_____(填字母)。
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2 的转化率
C.将初始投料增加 1 倍,可以提高CO2 的转化率
D.充入一定量的He 气,可以提高CO2 的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2 平衡转化率影响的曲线。

① 反应 A 的ΔH1_____0(填“>”或“<”)。
② 曲线 c 对应的投料是_____。
③ T1℃时,曲线c 对应的化学平衡常数_____1(填“大于”、“小于”或“等于”)。
(3)在一定条件下,利用 CO2 合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2 和H2 按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2 的转化率影响如图 2 所示。

由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_____。
(4)以 CO2 和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。

① GaN 电极上的电极反应式是_____。
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是_____L。
【答案】 AC < [1mol,6mol] 小于 升高温度,反应 B(副反应)的速率比反应(A)快 2H2O-4e-=O2+4H+ 1.12
AC < [1mol,6mol] 小于 升高温度,反应 B(副反应)的速率比反应(A)快 2H2O-4e-=O2+4H+ 1.12
【解析】
根据可逆反应化学方程式写出平衡常数表达式,由影响平衡移动的因素判断移动的方向;根据题中图示,判断反应放热还是吸热;根据化学平衡“三段式”计算平衡常数;根据题中图1和图2,分析CO2转化率升高而CH3OH产率减小原因;根据题图所给信息,判断正负极,写出电极反应,由电子守恒和电极反应计算CH4的体积(标况)。
(1)由CO2(g)+3H2(g)CH3OH(g)+H2O(g)反应可知,平衡常数表达式为K= ![]() ,答案为
,答案为![]() 。
。
A.由CO2(g)+3H2(g)CH3OH(g)+H2O(g)反应可知,是一个气体体积缩小的反应,总压强是一个变量,若反应达到平衡时,各物质的量不再变化,容器的总压强也不再改变,故A正确;
B.加入合适的催化剂,可以改变达到平衡的时间,但不影响平衡移动,CO2的转化率不变,故B错误;
C.将初始投料增加 1 倍,相当于增大压强,此反应是一个气体体积缩小的反应,平衡向右移动,可以提高CO2的转化率,故C正确;
D.充入一定量的He 气,由于整个体系恒温恒容,对平衡体系无影响,故D错误;
答案为AC。
(2)①由题中图示可知,随着温度升高,CO2的平衡转化率减小,则平衡逆向移动,升高温度,向吸热方向移动,故该反应正反应放热反应,ΔH1<0;答案为<。
②当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图象知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol;答案为n(CO2)=1mol,n(H2)=6mol。
③曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol,T1℃时,二氧化碳的平衡转化率为65%,转化的二氧化碳为0.65mol,容器体积为1L,则: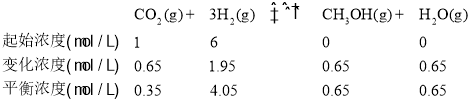 则平衡常数K=
则平衡常数K=![]() =
=![]() <1;答案为小于。
<1;答案为小于。
(3)因为A:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1<0,升高温度,平衡逆向移动,CH3OH的产率减小,符合图1,温度升高,而一氧化碳产率增大,可判断副反应B:CO2(g)+H2(g)CO(g)+H2O(g)平衡正向移动,△H2>0,所以升高温度时副反应B:CO2(g) + H2(g)CO(g) + H2O(g)△H2>0,速率比A更快,平衡正向移动,CO2转化率更大,对于A来说,平衡逆向移动,CH3OH的产率减小;答案为升高温度,反应 B(副反应)的速率比反应A快。
(4)①根据装置图,铜电极上通入了CO2,生成了CH4,C元素化合价降低,得到电子发生还原反应,作正极,CaN表面水失电子生成氧气,O元素的化合价升高,发生氧化反应,作负极,则电极反应为2H2O-4e-=O2↑+4H+;答案为2H2O-4e-=O2↑+4H+。
②Cu作正极,电极反应为CO2+8e-+8H+=CH4↑+2H2O,当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积V(CH4)=![]() =1.12L;答案为1.12。
=1.12L;答案为1.12。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%


